E d u c a c i ó Q u í m i c a
Divulgació de la química
Divulgar la química: com, a qui i per què?
Los avances de la química y su impacto en la sociedad
«The periodic table of videos»: an excellent bridge between university research and the high school chemistry classroom
«UAu, això és química!»

S o c i e t a t C a t a l a n a d e Q u í m i c a - F i l i a l d e l ’ I n s t i t u t d ’ E s t u d i s C a t a l a n s
2 0 1 4 n ú m e r o 1 8
EduQ
Educació Química EduQ
Juny2014,número18
Editors
FinaGuitart,CESIRE-CDEC,SCQ,Barcelona
AureliCaamaño,SCQ,Barcelona
Consell Editor
JosepCorominas,EscolaPia,Sitges
JordiCuadros,IQS-URL,Barcelona
JosepDurán,UdG,Girona
PereGrapí,INSJoanOliver,Sabadell
ÀngelMesseguer,CSIC,Barcelona
NeusSanmartí,UAB,Barcelona
MontseTortosa,INSFerranCasablancas,Sabadell
AmparoVilches,UV,València
Consell Assessor
Consell Assessor Catalunya / Espanya
JoanAliberas,INSPuigCadafalch,Mataró
MiquelCalvet,INSCastellar,CastellardelVallès
FrancescCentellas,UB,Barcelona
ReginaCivil,EscolaSakado,Barcelona
AnicetCosialls,INSGuindàvols,Lleida
CarlosDurán,CentroPrincipia,Màlaga
XavierDuran,TV3,Barcelona JosepMFernández,UB,Barcelona
DolorsGrau,UPC,Manresa
PazGómez,INSProvençana,l’HospitaletdeLlobregat
ElviraGonzález,CentrodeCiencias,Bilbao
PilarGonzálezDuarte,UAB,Barcelona
RuthJiménez,UAL,Almeria
TeresaLupión,CentrodeRecursosUMA,Màlaga
MaríaJesúsMartín-Díaz,IESJorgeManrique,Madrid
ConxitaMayós,Departamentd’Ensenyament,Barcelona
JoséMaríaOliva,UCA,Cadis
GabrielPinto,UPM,RSEQ,Madrid
MartaPlanas,UdG,Girona
AnnaRoglans,UdG,Girona
NúriaRuiz,URV,Tarragona
OlgaSchaaff,EscolaRosadelsVents,Barcelona
MartaSegura,EscolaPiaNostraSenyora,Barcelona
RosaMariaTarín,UAB,Barcelona
RomàTauler,IDAEA-CSIC,Barcelona
GregoriUjaque,UAB,Barcelona
NoraVentosa,ICMAB-CSIC,Barcelona
JosepAntonVieta,UdG,Girona
Consell Assessor Internacional
MaríadelCarmenBarreto,UniversitatdePiura,Perú
LiberatoCardellini,UPolitecnicadelleMarche,Itàlia
AgustinaEcheverria,UniversitatFederaldeGoiás,Brasil
SibelErduran,UniversitatdeBristol,RegneUnit OdillaFinlayson,UniversitatdeDublín,Irlanda
AndoniGarritz,UNAM,Mèxic
LidiaGalagowsky,UniversitatdeBuenosAires,Argentina
MarceloGiordanUniversitatdeSãoPaulo,Brasil
GiselaHernández,UNAM,Mèxic
ÈricJover,ObservatoridelaSostenibilitatd’Andorra
IsabelMartins,Universitatd’Aveiro,Portugal
EduardoMortimer,UniversitatdeMinasGerais,BeloHori-
zonte,Brasil CarlosJavierMosquera,UniversitatDistrital,Bogotà,Colòmbia
FátimaPaixão,CasteloBranco,Portugal
VincentParbelle,LycéeLaMartinière,Lió,França
IlkaParchmann,UniversitatdeKiel,Alemanya
MarioQuintanilla,PontifíciaUniversitatCatòlica,Xile
SantiagoSandi-Urena,UniversitatdeTampa,Florida,EUA
WilsondosSantos,UniversitatdeBrasília,Brasil
VicenteTalanquer,Universitatd’Arizona,EUA
Societat Catalana de Química (SCQ)
http://blogs iec cat/scq/
President:RomàTauler filialdel’ Institut d'Estudis Catalans (IEC)
BarcelonaCatalunyaEspanya
Impressió:GráficasRey ISS
ÍNDEX
Editorial
Divulgació de la química ..........................3
Aureli Caamaño, Fina Guitart i Josep Duran
Monografia: Divulgació de la química
Divulgar la química: com, a qui i per què? ...........4
Xavier Duran
Los avances de la química y su impacto en la sociedad 12
Luis Moreno-Martínez i Bernardo Herradón
¿Depurar el agua en Almería? ¿Para qué?
El uso de las controversias socioquímicas en la prensa 21
M Rut Jiménez Liso i Naira C Díaz Moreno
«The periodic table of videos»: an excellent bridge between university research and the high school chemistry classroom
Martyn Poliakoff, Samantha Tang, Brady Haran i Pep Anton Vieta «UAu, això és química!»
Josep Duran, Pep Anton Vieta, Tania López i Terenci Corominas
30
34
Petardos, cohetes y mucha química ................44
Fernando Ignacio de Prada Pérez de Azpeitia
Un espectacle de química amb productes quotidians 52
Josep Corominas
El vi com a recurs didàctic 57
José Antonio Martínez Pons
Imatge de portada: Teatre de Bescanó. Bescanó (Gironès). Autor: Sergi Reig.


a
MercèIzquierdo,UAB,Barcelon
ClaudiMans,UB,Barcelona
N:2013-1755 DipòsitLegal:B-35770-2008
Editorial
Monografia:
«Divulgació de la química»
La divulgació de la ciència, i de la química en particular, ha adquirit en les últimes dècades una importància cabdal. Però, fins als anys setanta, el paper de la ciència en la societat era poc considerat i molt criticat, i la divulgació científica s’entenia com una activitat de transmissió del coneixement científic a un públic amb una bona cultura científica, no com una veritable comunicació científica per a auditoris no especialitzats, és a dir, per al públic en general. Els divulgadors o comunicadors científics es van esforçar a apropar els seus discursos als interrogants reals dels noespecialistes. Es va passar així d’una lògica de la difusió a una lògica de la comunicació.
En aquest canvi va ser fonamental la implicació dels mitjans de comunicació i de les revistes de divulgació científica, dels nous museus i centres de ciències, de les fires de ciències, dels programes de comunicació científica i dels departaments de comunicació de les universitats, així com dels centres d’investigació i de les empreses. El comunicador científic, que havia estat desemparat fins a aleshores, va esdevenir un actor principal, en convertir-se en una persona immersa professionalment en l’entorn de la divulgació científica i que actua com a mediadora entre científics i ciutadans. Encara actualment, el mateix científic o professor de ciències és qui dedica de forma altruista part del seu temps a aquesta activitat.
És clar que la comunicació científica és clau per al foment de les vocacions científiques, com també ho són els professors, veritable referent per als alumnes en la tria del seu possible futur professional.
En el monogràfic actual hem volgut abordar el tema de la divulgació de la química a través de vuit articles. Els dos primers situen de manera general l’esmentat paper de la divulgació amb un recorregut per diversos exemples o l’explicació d’accions realitzades, com ara un curs de formació. Aquests articles són «Divulgar la química: com, a qui i per què?», de Xavier Duran, director del programa El medi ambient de TV3 i de diversos llibres de divulgació, i «Los avances de la química y su impacto en la sociedad», de Luis Moreno-Martínez, professor de Física y química de batxillerat, i Bernardo Herradón, investigador científic a l’Institut de Química Orgànica del CSIC i director del curs que porta el mateix títol que l’article.
A continuació, en l’article «¿Depurar el agua en Almería? ¿Para qué? El uso de las controversias socioquímicas en la prensa», M. Rut Jiménez Liso i Naria C. Díaz Moreno, de l’Àrea de Didàctica de les Ciències Experimentals de la Universitat d’Almeria, tracten l’ús de les controvèrsies científiques amb el públic en general i també a les aules, i reflexionen sobre les dificultats de comprensió entre científics i periodistes com a punt de partida d’una divulgació que es transformi en comunicació científica com a procés educatiu.
Els dos articles següents aborden la divulgació química entre la recerca universitària i la docència a secundària. Martyn Poliakoff, Samantha Tang i Brady Haran, de la Universitat de Nottingham, i Pep Anton Vieta, de la Universitat de Girona, presenten a l’article «“The periodic table of videos”: an excellent bridge between university research and the high
school chemistry classroom» una col·lecció de vídeos dels elements químics de la taula periòdica que tenen l’objectiu de desvetllar vocacions científiques entre l’alumnat, millorar la visió de la química i incrementar la cultura científica de la societat. Josep Duran, Pep Anton Vieta i Tania López, de la Universitat de Girona, i Terenci Corominas, de l’Escola Universitària ERAM, presenten a l’article «“UAu, això és química!”» un conjunt de vídeos de curta durada sobre temes del currículum de Química de batxillerat com una eina al servei dels professors de secundària que pot esdevenir una bona forma d’introduir o de finalitzar els temes de química a l’aula.
Finalment, els tres articles següents ofereixen recursos per a una divulgació de la química entre el gran públic i també per a la motivació de l’alumnat i la contextualització dels continguts. Fernando Ignacio de Prada Pérez de Azpeitia, de l’IES Las Lagunas de Rivas (Madrid), en l’article «Petardos, cohetes y mucha química», proposa utilitzar els efectes espectaculars dels petards i els coets com a recurs didàctic per a l’ensenyament de la química. L’article «Un espectacle de química amb productes quotidians», de Josep Corominas, de l’Escola Pia de Sitges, mostra que la química es troba en els productes i els materials quotidians i proposa alguns experiments que evidencien reaccions i efectes sorprenents. Finalment, José Antonio Martínez Pons, de l’IES Las Lagunas de Rivas (Madrid), en l’article «El vi com a recurs didàctic», presenta el vi com a fil conductor d’un conjunt d’experiències per dur a terme a l’aula que són un exemple de contextualització de continguts, cosa que podria ser un exemple de context per apropar la química al públic en general.
Els articles del monogràfic han estat escollits amb la intenció de presentar una varietat d’aportacions que orbiten al voltant de la divulgació de la química. Volen transmetre la passió dels autors per la comunicació científica i qui sap si encomanar-la al lector.


 Aureli Caamaño i Fina Guitart Editors d’Educació Química EduQ
Josep Duran
Coordinador de la monografia «Divulgació de la química»
Aureli Caamaño i Fina Guitart Editors d’Educació Química EduQ
Josep Duran
Coordinador de la monografia «Divulgació de la química»
Divulgar la química: com, a qui i per què?
Divulging chemistry: how, to whom and why?
Xavier Duran / Televisió de Catalunya
resum

La divulgació de la ciència té diversos objectius: a més de la transmissió de coneixement a un públic general, pot apropar la feina de l’investigador i promoure el debat sobre l’impacte social dels avenços científics. En el cas de la química, la divulgació pot ajudar a millorar una imatge distorsionada. En aquest article, apuntem algunes reflexions i mostrem com la ubiqüitat de la química permet trobar nombrosos temes i excuses per divulgar-la.
paraules clau
Divulgació-ensenyament, objectius i nivells de la divulgació, vocacions científiques, imatge de la química.
abstract
The dissemination of science has several objectives: in addition to the transmission of knowledge to the general public, it can approach the work of the researcher, and promote debate on the social impact of scientific advances. In this case, chemistry disclosure, it can help improve a distorted image. This article suggests several ideas and shows how the ubiquity of chemistry allows numerous subjects and opportunities to disclose it.
keywords
Disclosure-teaching, objectives and levels of disclosure, scientific vocations, image of chemistry.
Introducció
El 1666, Marie Meurdrac va publicar La chymie charitable et facile, en faveur des dames (Meurdrac, 1999), un llibre divulgatiu que va veure diverses edicions en francès i que va ser traduït a l’alemany i a l’italià (fig. 1). De l’autora, no se’n sap gaire cosa, tret que devia ser germana d’una dama noble i que devia fer pràctiques de química en el seu laboratori. Això darrer es desprèn de l’explicació que dóna en el pròleg, on manifesta que havia escrit el tractat per a la seva pròpia satisfacció i per no oblidar «els coneixements que he adquirit amb un llarg treball i per diverses recerques moltes vegades reiterades».
L’obra, de més de tres-centes pàgines, ofereix una bona visió de
la química del moment i descriu els principis de la matèria i dels instruments de laboratori, amb referència als tres principis: sal, sofre i mercuri. Però la major part de l’obra està dedicada a temes pràctics sobre tintures, essències, remeis de salut i cosmètics. Després d’haver dubtat de publicar-lo, perquè l’obligació d’una dama, diu, no és ensenyar, l’autora dóna aquestes raons per justificar l’aparició del llibre: «Conté una gran quantitat de remeis infalibles per a la curació de les malalties, per a la conservació de la salut i diversos rars secrets en benefici de les senyores». Uns dos segles i mig després, el 1923, Rosa Sensat publicava Les ciències en la vida de la llar (Sensat, 1998), un llibre editat per l’Associació Protectora de l’Ensenyança
Catalana. És curiós que, en el pròleg, manifesti, entre altres coses, que, per a la dona, «el paper seu dins la família és tan espiritual, tan noble i elevat com l’exercici de la medicina o de l’advocacia». Però ens hem de situar en una època en què a Catalunya i altres països tot just començava l’esforç de donar una instrucció acurada a les dones, i que fins i tot en mitjans progressistes es podia jutjar que el primer deure de la dona era la família. En aquest context, cal valorar que la pedagoga destaqués que la dona ha de conèixer la raó de les coses que fa, i per això ha de saber física, química i fisiologia. El llibre ofereix uns coneixements bàsics d’aquestes ciències, però té una orientació molt pràctica perquè la dona pugui tenir cura de la casa i de la
ISSN 2013-1755, SCQ-IEC Educació Química EduQ número 18 (2014), p. 4-11 DOI: 10.2436/20.2003.02.129 http://scq.iec.cat/scq/index.html 4

família amb una base científica. Així, els trenta capítols parlen, entre altres coses, de la ventilació de la llar, de l’aigua, de tints i descoloridors, de la neteja dels vestits, de la composició i la preparació dels aliments o de nutrició.
Són, el de Meurdrac i el de Sensat, dos llibres que es troben entre la divulgació i l’educació, l’un explícitament de química i l’altre amb força continguts d’aquesta ciència. El que en podem destacar, a més que siguin de dues autores i que es dirigeixin a un públic femení, és que descriguin temes molt pràctics i relacionats amb la vida quotidiana. Entremig de tots dos se situa el llibre de l’anglesa Jane Marcet Conversations on chemistry, editat per primer cop el 1806 i que va conèixer setze edicions, amb unes vendes totals d’uns cent seixanta mil exemplars. En aquest cas, la forma de converses n’afavoria la comprensió i va ser utilitzat per educar noies i dones, però el contingut vol oferir una visió més àmplia de la química, ja que està
basat en conferències de Humphry Davy.
Tot plegat ens suggereix algunes dades per introduir el tema de la divulgació de la química. D’una banda, que sovint s’insisteix en el vessant pràctic d’aquesta ciència. De l’altra, que la divulgació de la química va veure en èpoques passades una gran popularitat (cent seixanta mil exemplars seria una xifra notable fins i tot avui dia). Però, en ple segle xxi, com hem de plantejar la divulgació de la química? I amb quins objectius i per a quin públic? Més que oferir respostes clares, el propòsit d’aquest article és donar una sèrie de dades i, sobretot, reflexions i opinions personals que siguin útils com a contribució a un debat més ampli. D’altra banda, tot i que la divulgació i l’ensenyament tenen públics, objectius i tècniques diferents, cadascun es pot beneficiar de l’altre i pot aprofitar materials o idees utilitzats en l’altre àmbit.
Per què cal divulgar la química?
La divulgació científica es pot definir de moltes maneres, però, bàsicament, es pot dir que consisteix a traduir a un llenguatge comprensible per a la major part del públic els coneixements científics. Ara bé, això és una definició general que necessita diverses ampliacions i una exposició d’objectius. Així, es poden divulgar els coneixements científics generals, però també episodis d’història de la ciència, el mètode científic, les motivacions dels investigadors, la utilitat dels seus treballs, els avenços recents, els condicionants i derivacions ètics, socials o econòmics, etc. Per tant, l’objecte de la divulgació científica pot ser molt ampli.
D’altra banda, els objectius també poden ser molt diversos: augmentar el bagatge cultural del públic general, entretenir, mostrar derivacions pràctiques que el
públic pot utilitzar (o que, en tot cas, poden ser-li d’interès), permetre un seguiment de l’actualitat científica, fomentar el debat sobre l’impacte social de la ciència, etc.
La divulgació científica es pot definir de moltes maneres, però, bàsicament, es pot dir que consisteix a traduir a un llenguatge comprensible per a la major part del públic els coneixements científics
Això ens porta a derivacions pràctiques de la divulgació. Per a Aït-el-Hadj i Bélisle (1985), la divulgació transmet la informació necessària per adaptar-se a un entorn tecnològic en evolució i supleix les institucions en la seva incapacitat d’adaptar-se de forma prou ràpida a aquests canvis per assegurar aquesta transmissió. En aquest sentit, la divulgació complementaria l’educació. D’una banda, perquè la ciència evoluciona i la majoria de la gent no té altres formes (o no les busca) per estar mínimament al dia que els mitjans de comunicació (i quan hi posa un interès especial, llibres o conferències). D’altra banda, perquè, fins i tot durant l’ensenyament, la majoria dels alumnes patiran mancances en la seva formació científica, entre altres coses, perquè les assignatures obligatòries de ciències s’acaben a tercer d’ESO i, en el cas de les matemàtiques, a quart (a primer de batxillerat hi ha, en aquests moments, dues hores de Ciències per al món contemporani, amb un futur incert segons la nova llei). Així, només aquells que segueixin estudis cientificotècnics tindran accés a aquesta formació, que no arribarà al gruix de la societat.
Monografia / Divulgació de la química Divulgar la química: com, a qui i per què? 5
Figura 1. Portada del llibre La chymie charitable et facile, en faveur des dames, de Marie Meurdrac.
Però la divulgació té altres funcions, de cara a la societat i de cara a la mateixa comunitat científica. En el primer cas, la societat s’enfronta a molts dilemes que tenen una base o un rerefons científic. Les tècniques de reproducció assistida, les manipulacions genètiques, la preservació del medi, les prospeccions petrolieres, l’energia nuclear i la protecció de dades personals, entre altres temes, han de ser debatuts en la societat i no només entre els experts. Però, en una societat democràtica, no n’hi ha prou amb tenir el dret d’opinar, manifestar-se o decidir en referèndum, sinó que els drets s’han d’exercir amb prou informació. Només els ciutadans amb prou informació són realment lliures per decidir. Per això la divulgació científica hi desenvolupa un paper important. I també cal destacar que aquesta divulgació pot ajudar a treure a la llum debats sobre dilemes que la majoria de la gent no sap ni tan sols que es produeixen. En aquest sentit, la divulgació és un element bàsic de la democràcia.
D’altra banda, a la comunitat científica li interessa que es difongui la ciència. A l’hora de plantejar, per exemple, si l’esforç en recerca i desenvolupament és prou important, si ha d’augmentar o ha de disminuir, una opinió pública informada i conscienciada tindrà opcions de fer més o menys pressió. A la comunitat científica li interessa que la gent sàpiga quina feina fa, com la fa i què se’n deriva, perquè així prendrà consciència de la importància de l’esforç públic i privat en recerca. No es tracta d’imaginar improbables manifestacions massives per demanar més diners i mitjans per investigar, sinó que una part important de la societat conegui prou les implicacions del tema perquè, d’una manera o d’una altra, pugui opinar o fer
pressió perquè això es mantingui. La democràcia no s’exerceix només votant cada quatre anys o cada quan toqui.
Hi ha encara un altre benefici de la divulgació, que és el de «captar vocacions», és a dir, fer veure als joves que hi ha un camp que els pot fascinar i que els pot proporcionar una dedicació professional. I això és molt important en un país com el nostre, mancat de científics i tecnòlegs, malgrat que, en les circumstàncies actuals, molts han de marxar a l’estranger.
En el cas de la química, la divulgació pot respondre a totes aquestes necessitats i funcions. Però tot depèn de quins objectius busquem, perquè això ens dirà a quin nivell hem d’arribar. I això depèn del públic al qual ens vulguem dirigir.
Divulgar la química: fins a quin nivell i per què?
La divulgació es pot dur a terme a nivells molt diferents. Tot depèn, d’entrada, de quins objectius busquem. Si volem que el receptor capti conceptes bàsics de la química, actuarem de forma diferent que si el nostre objectiu és que en conegui certs aspectes més pràctics. També és diferent si divulguem per a un públic general que no ha de tenir necessàriament formació científica o si ens adrecem a un públic més concret amb certs coneixements. En tot cas, és probable que per obtenir els nostres objectius haguem de simplificar una mica. Si volem arribar a un públic ampli o heterogeni, la necessitat de simplificar és més evident. I això no afecta només els conceptes, sinó també la forma de presentar la informació. Així, en química hi ha molts noms de compostos que poden provocar una certa aversió a lectors o oients. Però tampoc no sembla que la simplificació sigui sempre
La divulgació es pot dur a terme a nivells molt diferents. Tot depèn, d’entrada, de quins objectius busquem. Si volem que el receptor capti conceptes bàsics de la química, actuarem de forma diferent que si el nostre objectiu és que en conegui certs aspectes més pràctics
possible o recomanable. Potser dir o escriure tetrahidrocannabinol pot causar una certa confusió, però no més que els noms de ciutats o de personatges estrangers que apareixen sovint citats sense cap problema. No sembla fàcil esmentar el principi actiu de la cocaïna i no dir aquest nom. I afegint simplement que és una substància química no és probable que hi hagi més dificultats de comprensió. Una altra cosa seria abusar d’aquesta nomenclatura, si no és necessària, o fins i tot posar certes fórmules. Algunes són prou populars (H2O), d’altres poden ser assequibles (NaCl) i moltes poden confondre més que ajudar. Un grup de quatre professors francesos considerava, per la seva experiència, que «la química ha de ser divulgada sense utilitzar notacions simbòliques. És un esforç que cal acceptar per ser comprès per un públic ampli» (Maréchal et al., 2004). Els mateixos autors conclouen que «la divulgació de la química introdueix el problema de la simplificació, que ha de ser suficient perquè els comentaris fets siguin comprensibles, sense que sigui excessiva, per mantenir-se en el registre d’aquesta disciplina». Per tant, cal mantenir sempre un equilibri: simplificar per facilitar la comprensió, però sense perdre rigor.
Educació Química EduQ número 18 6
En el cas de la química, hi ha una altra dificultat per a la divulgació: la majoria de les coses passen en l’àmbit molecular o submolecular i no són visibles. Sí que se’n poden observar els efectes: canvis de color, aparició de productes a partir de reactius... Això, que representa un problema per difondre la química en museus, per exemple, sense utilitzar sessions actives, pot ser, d’altra banda, un element prou vistós per captar l’atenció sobre els canvis de la matèria. L’explicació d’aquests canvis dependrà, novament, del nivell fins on vulguem arribar.
D’altra banda, per què cal divulgar la química? A part dels objectius generals de la divulgació científica, en el cas de la química, això ajuda a millorar una imatge força distorsionada. L’inici de la pèrdua de popularitat de la química es pot situar en diversos moments (Chastrette i Dumon, 2007): amb les armes químiques utilitzades a la Primera Guerra Mundial, amb els primers fracassos dels antibiòtics, amb l’aparició de medicaments perillosos com la talidomida, amb el descobriment dels efectes nocius del DDT o amb la presa de conscièn-
cia sobre la contaminació (fig. 2). Hi ha qui va més enrere i recorda que, ja al segle xix, hi va haver aspres discussions pel desenvolupament de la química pesant i el seu impacte ambiental, al mateix temps que hi ha hagut un desenvolupament de la producció massiva per una societat consumista sense gaires escrúpols pels danys que deixava al darrere (BensaudeVincent, 2004).
Per això, i fos quan fos que va començar la pèrdua d’imatge, la química fa front a un parell de grans reptes: té la culpa de nombrosos desastres, sense que se li reconeguin molts beneficis, i se la presenta com a antagònica de les coses naturals. La divulgació pot ajudar al canvi d’imatge, però, probablement, l’ajut principal contra la quimiofòbia vingui de la mateixa indústria, amb uns processos menys agressius i amb una aposta per contribuir al desenvolupament sostenible. No es tracta de netejar la imatge, sinó de canviar moltes maneres d’actuar. Com diu Jean Jacques, «havent contribuït la química decisivament a fundar la societat industrial en què vivim, n’és a partir d’ara el símbol en allò que

ens aporta de més artificial, de més nauseabund i de més hipòcritament inhumà. Representa, per les seves conseqüències i amenaces, el detestable preu a pagar per un confort que hom hauria volgut més fàcil de suportar» (Jacques, 1981). Novament, els efectes negatius semblen pesar més que els beneficis.
En el cas de la química, hi ha una altra dificultat per a la divulgació: la majoria de les coses passen en l’àmbit molecular o submolecular i no són visibles. Sí que se’n poden observar els efectes: canvis de color, aparició de productes a partir de reactius...
No creiem que la millora de la imatge s’aconsegueixi amagant les coses o amb estratègies més comercials o dialèctiques que pràctiques. A part que el fet d’amagar coses o dir mitges veritats va contra l’ètica de la divulgació, no ho considerem una mesura efectiva. No es tracta de fer campanyes de publicitat: «Els temps de les croades on les companyies químiques llustraven els seus blasons finançant campanyes publicitàries ha acabat» (Bensaude-Vincent, 2004). Es tracta de reconèixer errors i de demostrar que hi ha hagut un canvi d’actitud real.
Dit això, sí que pot ajudar a millorar la imatge de la química el fet d’explicar millor quines aportacions fa a la societat, com actua per disminuir els impactes negatius i de quina forma es treballa a la indústria. L’experiència de la indústria química a la regió de Roine-Alps (Chastrette
de la química 7
Monografia
/ Divulgació
Figura 2. Imatge d’una fàbrica nord-americana del segle xix. La indústria química ha estat associada sovint a contaminació i perjudicis per a la salut i el medi.
Divulgar la química: com, a qui i per què?
los niños aman la química
Entusiasmar a las nuevas generaciones con la química es importante para la humanidad. En Tarragona hemos abierto el ‘Centro de Visitas’, un lugar donde cada año centenares de jóvenes aprenden sobre química de un modo divertido. ¿Estudiantes y tubos de ensayo por fin se llevan bien? En BASF creamos química. www.basf.com/chemistry



8 Educació Química EduQ número 18
mm
mm T:297 mm
mm
S:200 mm S:287
T:210
B:220 mm B:307
Figura 3. Exemples de divulgació de la química des de la indústria.
i Dumon, 2007) o la campanya BASF Kids poden ser citades com a exemples en positiu (fig. 3). Explicar els objectius i la forma de treballar de l’anomenada química verda també pot ajudar molt en aquest sentit (Domènech, 2005).
Un altre combat és el terminològic. Intentar que es parli de compostos sintètics i no de compostos químics quan ens referim, per exemple, a plaguicides no naturals és un exercici de rigor, però ben difícil d’assolir (les feromones també són productes químics). El costum està molt estès i la majoria dels professionals de la comunicació no distingeixen el matís. Pensem que errors més flagrants, com ara traduir chemicals per ‘químics’, estan arrelant sense que els qui tant demanen més formació en llengües s’escandalitzin ni poc ni gaire.
Les temàtiques: aprofitar l’actualitat
Una forma de combatre aquesta aparent oposició entre natural i químic pot ser buscar temes que permetin explicar química a partir de fets ben naturals. Michael Faraday va utilitzar simplement la flama d’una espelma per divulgar alguns processos físics i químics —les seves conferències van ser publicades el 1861 (Faraday, 2004). Parlar de colorants sintètics pot permetre recordar el paper dels químics en l’obtenció i l’ús de colorants vegetals (NietoGalan, 2001). Així es mostra que la química ha estat molt important fins i tot quan encara es feien servir majoritàriament colorants d’origen vegetal i animal.
En el camp de la natura, de la síntesi artificial i la indústria o de la història de la química, la quantitat de recursos que serveixen d’excusa per divulgar la química són immensos. Hi ha llibres que ofereixen una panoràmica deliciosa d’elements històrics, artístics, culturals, etc. (Greenberg, 2003;
Ordóñez i Pérez-Galdós, 2011). De la mateixa manera, són una lectura fascinant, un exemple de divulgació química i una font de possibles temes i exemples els llibres del premi Nobel Roald Hoffmann (Hoffmann, 1995; Hoffmann i Torrence, 1993).
Altres autors amb una obra molt àmplia i diversa i dels quals, per no allargar-nos massa, no citem cap llibre concret són John Emsley, Philip Ball i Claudi Mans. Si bé hem dit que una de les dificultats per divulgar la química és que molts processos no són visibles més que en els resultats, això també té un avantatge: la química provoca impactes directes o explica fets quotidians. En aquest sentit, la química és ben visible. En canvi, trobem moltes notícies de química en els mitjans de comunicació? Sabria la gent esmentar avenços químics recents?
La resposta a les dues preguntes seria no. Però ho seria segons com busquem la resposta o, fins i tot, segons com plantegem la pregunta. Si demanem a la gent pel seu interès en els mecanismes del càncer, no és probable que mostri indiferència. I aquests mecanismes es basen en processos moleculars que els investigadors biomèdics han anat esbrinant i que han permès avançar molt en la lluita contra el càncer. Al febrer es va destacar molt, i amb raó, el darrer estudi de Joan Massagué sobre la metàstasi (Massagué et al., 2014). Doncs això seria una oportunitat per explicar el paper de la bioquímica en la investigació sobre els mecanismes del càncer i en la recerca de fàrmacs que interfereixin en aquests processos.
Això permet constatar que hi ha notícies de gran impacte que permetrien destacar el paper de la química i que aquesta ciència apareix sovint, però no de manera explícita, en els mitjans. Pren-
En el camp de la natura, de la síntesi artificial i la indústria o de la història de la química, la quantitat de recursos que serveixen d’excusa per divulgar la química són immensos. Hi ha llibres que ofereixen una panoràmica deliciosa d’elements històrics, artístics, culturals, etc.
guem com a exemple el diari Ara del diumenge 2 de març. A la secció dominical de ciència, a la pàgina 39, s’explica la identificació d’un compost contingut en una planta xinesa que podria ser molt útil contra processos inflamatoris. Un compost que, òbviament, és una substància química, per molt natural que sigui. A la pàgina següent, el biòleg David Bueno posa al nostre abast un estudi que explica per què l’exercici físic ajuda a consolidar la memòria. Explica que, amb l’exercici, els músculs fabriquen una proteïna que després de diversos processos acaba induint canvis físics en el cervell. I això, a part d’ajudar a comprendre el fenomen, obre la porta a la recerca de fàrmacs contra certes patologies.
Per tant, la química està molt present en l’actualitat científica i, fins i tot, en la part d’aquesta actualitat que arriba, amb més o menys impacte, als mitjans de comunicació. El problema pot ser que la paraula química no apareix explícitament. En tot cas, de cara a combatre la imatge antinatural de la química, sembla positiu destacar el seu paper en aquests avenços.
La química també té una presència important en àmbits tecnològics on aquesta presència és sovint oblidada. És el cas de les
/ Divulgació de la
9
Monografia
química
la
a
i
Divulgar
química: com,
qui
per què?
tecnologies de la informació i la comunicació (TIC). Hi ha nous materials amb un futur prometedor —grafè, OLED (díodes orgànics d’emissió de llum)—, hi ha diversos tipus de polímers que serveixen de base per enllaçar elements funcionals, hi ha noves bateries més duradores i lleugeres... Fins i tot en el camp de les impressores no es valora prou el paper de la química per trobar pigments amb unes prestacions millors (Cabeza i Jiménez, 2013).
Història, art, literatura...
A part dels temes d’actualitat que, d’entrada, pot semblar que no l’afecten directament, la química es pot divulgar des d’àmbits molt diversos. La història, per exemple, s’explica gairebé sempre a partir de conflictes bèl·lics, moviments polítics i socials, intrigues àuliques, confrontacions ètniques o batalles comercials. Sense treure importància a cap d’aquests aspectes, caldria reconèixer que la ciència i la tecnologia també tenen un paper històric rellevant i no sempre (o gairebé mai) reconegut. I dintre de la ciència i la tecnologia, la química hi té el seu capítol. Molts descobriments químics han provocat, afavorit o, si més no, influït en canvis històrics. Això és evident tant si parlem de la vida quotidiana (amb canvis extraordinaris que, a la curta o a la llarga, també han ajudat a canviar la història) com de grans processos. Destacar aquest paper ajuda a divulgar no només diversos aspectes de la química, sinó també la seva rellevància social. D’exemples, n’hi ha molts (Duran, 2013), i en alguns casos, com el del radi, permeten explicar un munt de temes, des de la història d’un descobriment fins a la fantasia que va despertar en la literatura, el cinema o els còmics, passant per un impacte publicitari que el va dur a ser utilitzat de
manera abusiva en medicina o cosmètica (Cosset i Huynh, 2011). L’art és un altre àmbit que permet divulgar la química. Això es pot fer tant des de la perspectiva que la química i els químics han tingut en diverses èpoques en les obres d’art (Schummer i Spector, 2007) com incidint en allò que la química ha aportat en l’obtenció de pigments i que pot aportar ara en la identificació d’autors o en el descobriment de fraus (Duran, 2007).
Santiago Alvarez també ha elaborat articles molt diversos sobre la presència de la química en l’art, la música o la literatura. La llista seria molt llarga, però en destacarem a la bibliografia un dels nostres preferits (Alvarez, 2005) i el més recent, que permet enllaçar amb la literatura (Alvarez, 2013) i on també es poden trobar altres referències de l’autor.
La literatura és un àmbit que permet divulgar la química amb aspectes molt diversos, des de la imatge d’aquesta ciència i dels químics fins al seu aprofitament per construir metàfores o trames (Duran, 2002). La referència clàssica és Les afinitats electives, de Johann Wolfgang Goethe (Goethe, 1991) (fig. 4). Un autor ineludible és Primo Levi, de qui, a part d’altres lectures molt recomanables, podem destacar El sistema periòdic (Levi, 1998). I una altra de rellevant i més recent, d’un autor que utilitza la ciència i la tecnologia en gairebé totes les seves novel·les, és Ganancia, de Richard Powers (Powers, 2002).
No cal dir que tots aquests temes o possibilitats s’han de tractar també aprofitant les noves eines tecnològiques. Un bon exemple de com fer atractiva i actual la química seria l’aplicació sobre els elements químics basada en el llibre de Theodore Gray (Gray, 2011). L’aplicació es troba en versió per a iPad, iPhone i Mac. Inclou tot el llibre, però hi

Figura 4. Il·lustració de Les afinitats electives, de Goethe, una de les obres més citades quan es parla de química i literatura.
incorpora dinamisme i tridimensionalitat. Aquesta part ha estat traduïda al català per la doctora Pilar González. Hi ha una segona part, «Elements en acció», amb un experiment per a cada element, també traduïda, però, pel que sembla, pendent de revisió. De webs sobre química, amb recursos tant per divulgar com per aprofitar didàcticament, n’hi ha molts. Les nostres preferències ens fan destacar el de la Royal Society of Chemistry (http://www. rsc.org), el de ciència per a nens de l’American Chemical Society (http://www.acs.org/content/acs/en/ education/whatischemistry/scienceforkids.html), el de Chem4kids (http://www.chem4kids.com), amb traducció al castellà, i Chemistry for Kids (http://www.sciencekids.co.nz/ chemistry.html).
Conclusions
La divulgació científica compleix diversos objectius, des de la simple transferència de coneixement fins a la promoció del debat sobre l’impacte social de la ciència. En el cas de la química, la divulgació pot ajudar també a millorar una imatge pública molt
10
Educació Química EduQ número 18
malmesa. Creiem que hem ofert algunes idees i moltes referències que poden facilitar la divulgació de la química des de molts punts de vista, que incideixen en aspectes molt diversos i l’adrecen a públics molt diferents. L’ensenyament de la química pot beneficiar-se de tècniques i materials de la divulgació, però també la divulgació pot fer servir plantejaments propis de la didàctica. En tot cas, la forma d’utilitzar els recursos dependrà de què volem aconseguir i amb quin públic.
Una de les coses que cal destacar és que la presència de la química no sempre és evident i que fer-la aparèixer no només pot ajudar a la seva divulgació, sinó també a fer comprendre millor el seu paper. La divulgació de la química té un avantatge que no presenten totes les ciències: està present en la major part dels processos naturals i té una presència ubiqua en la nostra vida quotidiana. Per això ofereix unes possibilitats que, si les sabem aprofitar, poden canviar, en part, la visió pública d’aquesta ciència. No és probable que es desfacin tots els tòpics, però sí és possible obtenir una imatge pública de la química menys distorsionada que l’actual.
Referències
Aït-el-HAdj, S.; Bélisle, C. (ed.) (1985). Vulgariser: Un défi ou un mythe? Lió: Chronique Sociale. AlvArez, S. (2005). «Polyhedra in (inorganic) chemistry». Dalton Transactions, núm. 13, p. 22092233.
— (2013). «La taula periòdica, una àgora de l’art i la ciència». Educació Química EduQ, núm. 15, p. 4-18.
BensAude-vincent, B. (2004). «Chimie et société: des relations tumultueuses». L’Actualité Chimique, núm. 280-281, p. 22-24.
cABezA, L.; jiménez, A. (2013). «La química de la información».
QeI: Química e Industria, núm. 607, p. 10-13.
cHAstrette, M.; dumon, A. (2007). «L’image de la chimie est mauvaise. Pourquoi? Quoi faire?». Didaskalia, núm. 30, p. 139-154.
cosset, J.-M.; HuynH, R. (2011). La fantastique histoire du Radium: Quand un élément radioactif devient potion magique. Rennes: Ouest-France.
domènecH, X. (2005). Química verda. Barcelona: Rubes. durAn, X. (2002). «La química, amors i desamors literaris».
A: Font-Agustí, J. (coord.). Entre la por i l’esperança: Percepció de la tecnociència en la literatura i el cinema. Barcelona: Proa, p. 125152.
— (2007). L’artista en el laboratori: Pinzellades sobre art i ciència Alzira: Bromera.
— (2013). 100 molècules amb què la química ha canviat (poc o molt) la història. Valls: Cossetània.
FArAdAy, M. (2004). Historia química de una vela. Madrid: Nivola.
goetHe, J. W. (1991). Les afinitats electives. Barcelona: Proa.
grAy, T. (2011). Els elements: Una exploració visual de tots els àtoms de l’univers. Barcelona: Institut d’Estudis Catalans: Universitat Autònoma de Barcelona; València: Universitat de València.
greenBerg, A. (2003). The art of chemistry: Myth, medicines, and materials. Hoboke: John Wiley & Sons.
HoFFmAnn, R. (1995). The same and not the same. Nova York: Columbia University Press.
HoFFmAnn, R.; torrence, V. (1993). Chemistry imagined: Reflections on science. Washington; Londres: Smithsonian Institution Press.
jAcques, J. (1981). Les confessions d’un chimiste ordinaire. París: Seuil. levi, P. (1998). El sistema periòdic Barcelona: Edicions 62.
mArcet, J. (1806). Conversations on chemistry [en línia]. Londres: Longman, Hurst, Rees and Orme.
<http://www.rsc.org/Library/ Collections/Historical/Conversations/index.asp> [Consulta: 8 març 2014].
mArécHAl, J.-F. le; joyce, C.; jeAnmArie, O.; vincent, D. (2004). «Vulgariser la chimie: obstacles et solutions». L’Actualité Chimique, núm. 280-281, p. 39-43.
mAssAgué, J. [et al.] (2014). «Serpins promote cancer cell survival and vascular co-option in brain metastasis». Cell, vol. 156, núm. 5, p. 1002-1016.
meurdrAc, M. (1999). La chymie charitable et facile, en faveur des dames. París: CNRS.
nieto-gAlAn, A. (2001). Colouring textiles: A history of natural dyestuffs in industrial Europe Dordrecht; Boston: Kluwer Academic.
ordóñez, J.; Pérez-gAldós, N. (2011). El mundo y la química. Barcelona: Lunwerg.
Powers, R. (2002). Ganancia. Barcelona: Mondadori.
scHummer, J.; sPector, T. I. (2007). «The visual image of chemistry. Perspectives from the history of art and science». HYLE: International Journal for Philosophy of Chemistry, núm. 13, p. 3-41.
sensAt, R. (1998). Les ciències en la vida de la llar. Barcelona: Altafulla.

Xavier Duran És llicenciat en ciències químiques i doctor en ciències de la comunicació per la Universitat Autònoma de Barcelona. Des del 1999, és director del programa El medi ambient, de TV3. És autor de diversos llibres de divulgació i assaigs científics.
A/e: xduran.l@tv3.cat
/ Divulgació de la química 11
la química: com, a qui i per què?
Monografia
Divulgar
Los avances de la química y su impacto en la sociedad
Els avenços de la química i el seu impacte en la societat
Advances in chemistry and its impact on society
Luis Moreno-Martínez y Bernardo Herradón / Instituto de Química Orgánica General (IQOG-CSIC)
resumen

En el año académico 2013-2014 se ha celebrado la cuarta edición del curso de divulgación Los avances de la química y su impacto en la sociedad. En las cuatro ediciones, se han impartido un total de un centenar de conferencias de temas muy diversos, en las que se ha puesto de manifiesto el papel que la química juega en el bienestar de la humanidad. En este artículo se presentan brevemente algunos de los temas tratados en los cursos, que demuestran cómo los avances de la química en diversas áreas proporcionan numerosos beneficiosos al ser humano.
palabras clave
Química y sociedad, energía, salud, alimentos, medio ambiente.
resum
L’any acadèmic 2013-2014 s’ha celebrat la quarta edició del curs de divulgació Els avenços de la química i el seu impacte en la societat. En les quatre edicions, s’han impartit un total d’un centenar de conferències de temes molt diversos, en què s’ha posat de manifest el paper que la química desenvolupa en el benestar de la humanitat. En aquest article es presenten breument alguns dels temes tractats en els cursos, que demostren com els avenços de la química en diverses àrees proporcionen nombrosos beneficis a l’ésser humà.
paraules clau
Química i societat, energia, salut, aliments, medi ambient.
abstract
The fourth edition of The advances in chemistry and its impact on society outreach course was held in the 20132014 academic year. In the four editions, a total of about one hundred lectures were given on very diverse subjects, which have highlighted the role that chemistry plays in human welfare. This article briefly discusses some of the topics covered in the courses, which demonstrates how advances in chemistry provides numerous benefits to humans in several diverse areas.
keywords
Chemistry and society, energy, health, food, environment.
El ser humano y las sustancias químicas
La química es la ciencia que conecta la realidad de la materia con su composición íntima. Todos interaccionamos cada día con miles de sustancias químicas. La inmensa mayoría, para nuestro
beneficio, aunque no seamos conscientes de ello.
Por ejemplo, el aire que respiramos es una mezcla homogénea de sustancias químicas en estado gaseoso: el nitrógeno, el oxígeno, el dióxido de carbono, el argón, el agua, etc. Todos los alimentos que
ingerimos son mezclas de sustancias químicas: proteínas, carbohidratos, grasas, sales minerales, vitaminas, etc. El agua (H2O) que bebemos es una sustancia molecular, posiblemente la sustancia molecular más importante, pero el agua potable no es agua pura,
ISSN 2013-1755, SCQ-IEC Educació Química EduQ número 18 (2014), p. 12-20 DOI: 10.2436/20.2003.02.130 http://scq.iec.cat/scq/index.html 12
sino una disolución acuosa con multitud de iones, que es lo que la hace potable. Si ingiriésemos agua pura en gran cantidad, podríamos tener problemas de salud, pues el agua podría provocar un desequilibrio en el balance de electrolitos del organismo, lo que produciría cambios en la presión osmótica en el interior de las células y alteraciones en la concentración de algunos iones (por ejemplo, sodio o potasio) fundamentales para el equilibrio homeostático celular.
También podemos mencionar que los medicamentos que usamos para curar o paliar los síntomas de alguna enfermedad son una mezcla de sustancias químicas en las que el principio activo (lo que cura) se encuentra, generalmente, en una pequeña cantidad y el resto del medicamento son aditivos que facilitan su manejo, absorción, etc. Pero pensemos en un día cualquiera de nuestra vida, en el que en todas las cosas cotidianas manejamos sustancias químicas: en los productos de higiene y cosmética, en las tareas de limpieza, en el transporte, en el trabajo, etc. (fig. 1).
Incluso nosotros mismos somos una mezcla de sustancias químicas que realizan diversas funciones: suministrar y almacenar energía, ser el soporte físico del cuerpo, mover nuestros mús-
culos, hacer que funcione el sistema nervioso, facilitar la respiración, etc. De hecho, aunque puede definirse de muchas maneras, para un químico, la vida es «un conjunto de sustancias y procesos químicos que son capaces de organizarse y reproducirse».
Una definición de química y su relación con las ciencias naturales
La química es una de las cuatro ciencias naturales clásicas. Las otras son la física, la geología y la biología. Las ciencias naturales estudian la energía, la materia y la interacción entre ambas. Dependiendo del objeto y de los métodos de estudio, tenemos las diferentes ciencias naturales. A partir de las interacciones de estas cuatro ciencias, surgen nuevas áreas científicas interdisciplinares, como la bioquímica, la geofísica, la biofísica, la fisicoquímica, la biología molecular, las ciencias medioambientales, la paleontología, la toxicología, etc. Con el desarrollo de las ciencias, sus fronteras y áreas de estudio se van haciendo cada vez más difusas, llegando a una situación donde no es fácil definir precisamente una ciencia determinada.
Una definición amplia de la química es la siguiente: «La ciencia que estudia la composición,

estructura, propiedades y transformaciones de la materia, especialmente a nivel atómico y molecular».
En esta definición hay dos aspectos que hay que resaltar. Por un lado, la materia ordinaria (cotidiana) que nos rodea está formada por átomos y moléculas, que son el objeto de estudio de la química, lo que nos lleva a concluir que la química es «la ciencia de las cosas cotidianas». Por otra parte, tenemos que destacar que la química es la ciencia del cambio, la ciencia que estudia las transformaciones de la materia a través de reacciones químicas, que son los procesos en los que una especie química se convierte en otra.
Los constituyentes fundamentales de la materia son los átomos. Un átomo está constituido por un núcleo con carga positiva (debida a los protones) rodeado de electrones, que son partículas muy pequeñas con carga eléctrica negativa. En un átomo eléctricamente neutro, el número de protones es igual al número de electrones. Cuando un átomo (o agrupación de átomos) gana o pierde electrones, se forma un ión, que puede ser negativo o anión, si gana electrones, o positivo o catión, si pierde electrones.
Las sustancias químicas (y, por lo tanto, la materia que se forma a partir de ellas) deben su existencia a que son estables desde un punto de vista energético. Esta estabilidad se debe a la presencia de enlaces químicos, que se producen cuando dos o más átomos interaccionan entre sí, compartiendo electrones o intercambiándolos. Los enlaces pueden ser principalmente de tres tipos: iónicos (interacción entre aniones y cationes), metálicos (la interacción electrostática entre una nube de electrones de los átomos metálicos participantes y los respectivos iones positivos) o covalentes
Monografia / Divulgació de la química Los avances de la química y su impacto en la sociedad 13
Figura 1. El ser humano y las sustancias químicas.
(en los que cada uno de los átomos que forman el enlace comparte electrones), dando lugar a estructuras gigantes iónicas, metálicas y covalentes o a estructuras moleculares, en las que intervienen también las fuerzas intermoleculares.
La capacidad que tiene la química de transformar la materia se basa en las reacciones químicas que sufren las especies químicas, que transcurren a través de la formación, la ruptura y el reordenamiento de enlaces, lo que implica el movimiento de electrones entre las partículas que constituyen las especies químicas. El hecho de que los químicos podamos realizar estas transformaciones a voluntad (tras un diseño basado en el conocimiento científico) es uno de los grandes potenciales de la química y su impacto en la sociedad.
Otras «visiones» sobre la química
La definición anterior, aunque académicamente correcta, no recoge la esencia de lo que la química es hoy en día. Otras «visiones» de la química son las siguientes:
a) La química es la ciencia central, útil y creativa.
b) La química es la ciencia que está entre la física y la biología.
c) La química es la ciencia que está entre la biomedicina y la ciencia de los materiales.
d) La química es la ciencia que crea su propio objeto.
e) La química es la ciencia de las cosas cotidianas.
A continuación se discutirán estos aspectos.
La química, la ciencia central
Las sustancias químicas son herramientas útiles para estudiar procesos y desarrollar teorías en otras áreas científicas, contribuyendo al progreso de otras ciencias. Por esta razón, se considera
que la química es la ciencia central. La química interacciona con otras ciencias, como las ciencias biológicas, las ciencias agrarias, la ciencia de los alimentos, la toxicología, las ciencias medioambientales, las ciencias de la Tierra, la ciencia de los materiales, etc. La relación de la química con las otras ciencias queda reflejada en la fig. 2.
cos interesados en teoría de grafos, topología y teoría de grupos), aunque ello sí ha sucedido al contrario: las matemáticas, como ocurre en su relación con otras ciencias, aportan métodos de cálculo, modelización de resultados y base teórica a la química.
Por otro lado, la relación con la física se indica con una flecha de doble punta, lo que indica que la

Como se indica, en la mayoría de los casos, la flecha que une la química con la otra ciencia está orientada de la química a la otra ciencia. Esto quiere decir que la química aporta objetos de estudio (sustancias químicas), conceptos y métodos para que las otras ciencias estudien fenómenos y/o generen productos de consumo, contribuyendo a su avance. Además, cuando dos de las ciencias no unidas directamente lo hacen, lo deben hacer a nivel íntimo de la materia, generalmente a nivel molecular, y, en este caso, estamos hablando de química.
En la fig. 2, la relación de la química con las matemáticas y la física se indica por una flecha de sentido contrario (las matemáticas) y de doble punta (la física). En el primer caso, se pone de manifiesto que, de momento, la química apenas ha aportado nada a las matemáticas (excepto algún objeto de estudio para matemáti-
física proporciona la mayoría de los fundamentos de la química, pero que el progreso en ciertas áreas de la física se puede realizar cuando se usan sustancias químicas para realizar experimentos.
También hay que destacar que la química siempre ha mantenido una relación especial con la física y la biología. A veces se ha definido la química como «la ciencia entre la física y la biología». En comparación con la física y la biología, que tienen como objetivos respectivos descifrar las leyes que gobiernan el universo y desentrañar las razones de la vida, la química, aparentemente, tiene objetos de estudio y objetivos más modestos. Aunque los objetivos de la química son modestos en comparación con los de la física o la biología, es la ciencia que proporciona todas las comodidades de nuestra vida diaria, como se expondrá más adelante.
14 Educació Química EduQ número 18
Figura 2. La centralidad de la química y su relación con las otras ciencias.
También hay que mencionar que la relación entre la biología, la química y la física tiene connotaciones filosóficas, siendo un tema de interés en la filosofía de la ciencia. Brevemente, se puede decir que existen dos posiciones extremas: el reduccionismo y el autonomismo. El reduccionismo implica que una ciencia puede explicarse usando las leyes de otra ciencia, mientras que el autonomismo defiende que cada ciencia tiene sus propias leyes, independientes unas de otras. Así, las preguntas que se pueden hacer son: ¿puede la física explicar la química?, o bien ¿puede la química explicar la biología? El espacio y el carácter de este artículo no permiten profundizar en las respuestas a estas preguntas.
La química entre la biomedicina y la ciencia de los materiales: el futuro de la humanidad
Actualmente, la química ha ido cambiando su relación especial con la física y la biología por las relaciones con la biomedicina y la ciencia de los materiales. Estas dos áreas del conocimiento serán fundamentales en el progreso de la humanidad en las próximas décadas, contribuyendo a mejorar nuestra salud y proporcionando los utensilios necesarios para nuestro bienestar (fig. 3).
La biomedicina es un área multidisciplinar que tiene por objetivo mejorar la salud humana. En el desarrollo de la biomedicina participan otros numerosos campos científicos, desde actividades prácticas, como la medicina, hasta ciencias básicas, como las matemáticas, como se indica en la fig. 3. Las aportaciones de la química a esta disciplina están relacionadas con el suministro de moléculas y se pueden concretar en tres áreas amplias e importantes.
Por un lado, los fármacos, que sirven para curar enfermedades o

La relación de la química con la biomedicina y las ciencias de los materiales y las naturalezas de estas áreas científicas.
paliar sus efectos, son sustancias químicas que los químicos diseñamos, sintetizamos y determinamos su estructura.
Además, estas moléculas con actividad biológica (incluso aunque posteriormente no se desarrollen como fármacos) son herramientas útiles en biología. Gracias a la disponibilidad de moléculas adecuadas, se están estudiando con detalle molecular numerosos procesos biológicos. Este conocimiento tiene dos vertientes: por un lado, se incrementa el conocimiento en biología y, por otro, permite un mejor tratamiento médico-farmacológico en caso de mal funcionamiento.
Un área de rápido desarrollo en los últimos años es la preparación de biomateriales capaces de reparar o reemplazar órganos y tejidos de nuestro cuerpo. En esta investigación, la química proporciona los componentes básicos (las moléculas con las que se preparan los biomateriales) y, por otro lado, el conocimiento químico sobre interacciones entre moléculas permite diseñar los biomateriales y racionalizar los resultados. En los avances en esta última área, son importantes los
progresos en biomedicina y en ciencia de los materiales.
La ciencia de los materiales es un área multidisciplinar con objetivos prácticos: crear materiales con propiedades definidas y múltiples aplicaciones, desde la producción y el almacenamiento de energía hasta dispositivos electrónicos, pasando por materiales de protección medioambiental, artilugios deportivos, etc. Al desarrollo de esta área contribuyen diversas ciencias, como se muestra en la fig. 3. Las propiedades de los materiales dependen de las sustancias químicas que los forman y de sus interacciones. La química es fundamental para proporcionar las sustancias químicas y la comprensión de sus interacciones, que son fundamentales para el diseño de los materiales.
Algunas aportaciones de la química a la ciencia de los materiales son:
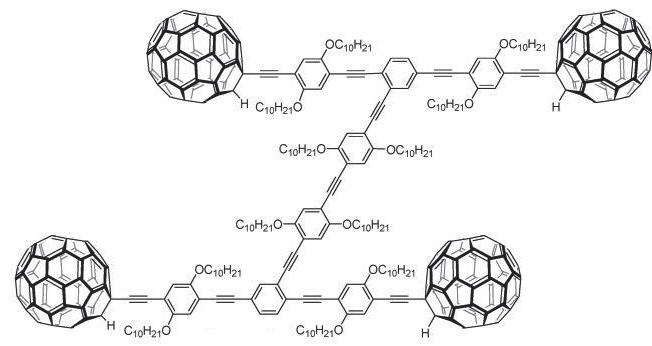
— Máquinas moleculares que, a nivel molecular, realicen trabajo mecánico (fig. 4).
— Nanomateriales (fig. 5).
— Equipos pequeños para monitorización (ambiental, salud, etc.).
— Electrónica molecular.
Monografia / Divulgació de la química 15 Los avances de la química y su impacto en la sociedad
Figura 3.
— Interruptores moleculares (en electrónica o en computación).
— Ordenadores moleculares.
— Nanocápsulas para el transporte de fármacos.
— Biomateriales inertes biológicamente o que se integren en el tejido (funcionales).
— Equipos portátiles para la purificación y potabilización de agua.
— Antenas de luz (conversión de energía lumínica en química, centros fotosintéticos artificiales).
— Materiales con óptica no lineal.
— Materiales quimioluminiscentes.
— Almacenamiento y transporte de hidrógeno.
— Materiales para el almacenamiento de electricidad (baterías y supercondensadores).
— Diodos emisores de luz.
— Materiales para la generación, la conversión y el almacenamiento de energía (con el menor impacto medioambiental).
En las últimas décadas, estamos asistiendo a un desarrollo espectacular de la nanociencia y sus aplicaciones: la nanotecnología. En esta área científica, se busca el diseño, la preparación y las aplicaciones de materiales nanoestructurados, es decir, en la escala del nanómetro (10−9 m). En esta escala, la materia puede presentar un comportamiento muy diferente respecto de la escala macroscópica, lo que puede servir para múltiples aplicaciones muy valiosas.
En definitiva, el futuro de la humanidad dependerá del desarrollo en biomedicina y en ciencia de los materiales. Los retos que la ciencia tiene por delante están basados en satisfacer las necesidades del ser humano (fig. 6), que podemos clasificar en cinco grandes áreas: energía, medio ambiente, salud, alimentación (incluyendo el suministro de agua potable a todo el planeta; la estructura

4. Ejemplos de máquinas moleculares en que las moléculas (el catenano, a la izquierda, y el azo compuesto, a la derecha) realizan trabajo mecánico al ser irradiadas con luz.


del agua se representa en la fig. 6) y tecnología (en la que el grafeno, representado también en la fig. 6, puede ser un material clave). Además, la ciencia debe tener connotaciones sociales, contribuyendo a acortar las brechas (sanitaria, social, económica) existentes entre seres humanos. La química será una ciencia fundamental para resolver estos retos científicos.








6. El papel de la química en el bienestar futuro de la humanidad.
La química crea su propio objeto
Desde la década de 1830, cuando ya se tenía suficiente conocimiento de la estructura de las sustancias químicas, los químicos se convencieron de que en sus manos tenían herramientas poderosas para obtener sustancias
(naturales o no) en los laboratorios. De estas investigaciones surgió el área de la síntesis química, que dio lugar a una de las definiciones más sugestivas de la química como «la ciencia que crea su propio objeto» (Berthelot, 1827-1907).
En esta frase está recogido el carácter creativo de la química, que la asemeja al arte, pues, en palabras del premio Nobel de Química Jean-Marie Lehn (nacido en 1937, premio Nobel en 1987): «La química es como el arte. Por ambos caminos obtienes cosas. Con la química, puedes cambiar el orden de los átomos y crear realidades que no existían».
Cuando los químicos se dieron cuenta de que podían crear nuevas sustancias químicas, empezaron a buscar aplicaciones. Ya en el siglo xix, la química era una ciencia de moda en la sociedad, pues proporcionaba muchas sustancias (mejoras en la producción de alimentos, tejidos, colorantes, jabones, metales, medicamentos) que facilitaban la vida de las personas. Actualmente, esta capacidad de la química de obtener sustancias y materiales es fundamental para el
16
Figura
Figura 5. Nanoestructura basada en el fullereno.
Figura
Educació Química EduQ número 18
La ciencia (la química) del futuro: satisfacer las necesidades de la sociedad
bienestar del ser humano, como se discute en el siguiente apartado.
Los beneficios de la química
En el curso de divulgación Los avances de la química y su impacto en la sociedad (fig. 7), hemos tratado aspectos relacionados con los beneficios que la ciencia aporta al ser humano en diversas facetas. Hemos insistido mucho en aspectos de nuestra vida cotidiana en los que la química aporta beneficios, lo que se muestra de manera esquemática en la fig. 8.

Figura 7. Logo de la cuarta edición del curso de divulgación Los avances de la química y su impacto en la sociedad.
Actualmente, gracias a las sustancias químicas, nuestra vida se beneficia en los siguientes aspectos: Salud humana. Con la química, tenemos principios activos para medicinas, materiales de diagnóstico, prótesis y muchos más materiales para cuidar nuestra salud. Además, la química también permite el progreso en biomedicina, proporcionando sustancias químicas para estudiar procesos biológicos que pueden estar relacionados con alguna enfermedad. Esta investigación ha dado lugar a un área científica de la biomedicina (la medicina molecular) que intenta entender las causas a nivel molecular de las enfermedades; este conocimiento permite diseñar principios activos más eficientes para tratar enfermedades.
Veterinaria. Antiguamente, la enfermedad de un solo miembro de una cabaña ganadera podía suponer el sacrificio de todo el rebaño; actualmente, cada individuo puede ser tratado con medicamentos veterinarios. Por supuesto, con sustancias químicas,

también cuidamos a nuestras mascotas y animales de compañía. Agricultura. Antes de plantar, es necesario conocer las características del suelo. Para ello se usan los métodos desarrollados por la química analítica que permiten analizar los componentes químicos del suelo, lo que facilita la elección del vegetal que se va a plantar, así como el tipo de nutrientes que se deben suministrar; por ejemplo, decidir qué concentración de nitrógeno, potasio y fósforo en el fertilizante debe usarse o si el vegetal necesitará sales metálicas, como calcio o magnesio, o oligoelementos, como hierro o molibdeno, que se suministran en muy pequeñas cantidades. Con sustancias químicas (pesticidas, herbicidas, insecticidas), tenemos agentes que protegen nuestras cosechas, evitando que las plagas puedan destruirlas o que las malas hierbas hagan más ineficaces los campos de cultivo. Estos son más productivos gracias a los fertilizantes, abonos, micronutrientes y sustancias relacionadas. Hay que recordar que todos estos agentes fitosanitarios deben usarse en la cantidad apropiada, no abusando de ellos, pues su exceso suele ser perjudicial para el medio ambiente. Por último, una vez recogida la cosecha, por métodos químicos podemos analizarla y determinar su conveniencia para el consumo.
Alimentación Una consecuencia de tener campos de cultivo más productivos es que tenemos más alimentos, bien porque directamente los consume el ser humano o porque sirven para alimentar el ganado que posteriormente consumiremos. De hecho, actualmente se dispone de suficientes alimentos para alimentar a todos los seres humanos de nuestra (superpoblada) Tierra. Si existe hambre en nuestro planeta, es un problema de distribución causado por razones políticas, económicas,
Monografia / Divulgació de la química 17 Los avances de la química y su impacto en la sociedad
Figura 8. La química en nuestra vida cotidiana.
sociales, etc., fuera del alcance de la ciencia. También hay que destacar que, una vez producido el alimento, no es necesario consumirlo inmediatamente, pues disponemos de sustancias químicas que evitan que las sustancias se contaminen con microorganismos (conservantes) o que se rancien (antioxidantes). Estos son dos de los distintos tipos de aditivos alimentarios que se usan actualmente en la industria alimentaria. Existen otros aditivos que permiten modificar el sabor de los alimentos (por ejemplo, endulzándolos sin aporte calórico), darles color (hay que recordar que la primera impresión de un alimento es a través de la vista), estabilizantes, correctores de la acidez, etc. Hay que mencionar que todos los aditivos alimentarios comercializados en la Unión Europea son catalogados por la letra E seguida de tres cifras (que los caracteriza según el grupo y la composición química), y también que este etiquetado garantiza que han pasado los controles de seguridad necesarios. La fig. 9 muestra esquemáticamente las diferentes aportaciones que la química hace en la producción y mejora de los alimentos.

Potabilización y purificación de agua. Posiblemente la mayor aportación de la química al bienestar de la humanidad sea la purificación y potabilización de agua, aunque probablemente la opinión pública no es consciente del papel que la química tiene en este proceso. La purificación de agua de-
pende de sustancias químicas como el ozono o el dióxido de cloro, que son agentes oxidantes y bactericidas que eliminan las impurezas y los microorganismos en el agua. El proceso se completa con una serie de tratamientos químico-físicos, como floculaciones o filtraciones a través de membranas también fabricadas con moléculas. Disponer de agua potable para beber o para nuestra higiene o de agua pura para regar las plantas marca diferencias entre los seres humanos, entre los países ricos y los países pobres. Un aspecto importante es que tenemos que conseguir métodos de purificación de agua que sean transportables a cualquier lugar del planeta.
Energía. ¿Nos podemos imaginar un planeta con problemas de suministro de energía? De ella dependemos para movernos, calentarnos, iluminarnos, refrigerarnos, conservar alimentos, hacer funcionar equipamientos, etc. Actualmente, nuestra sociedad es consumidora en exceso de energía. Esto es consecuencia de nuestro progreso. Nuestra principal fuente de energía es la combustión de carbón, de derivados del petróleo y de gas natural. La energía procede de reacciones de oxidación de carbono e hidrocarburos que son exotérmicas (generadoras de energía, generalmente en forma de calor). Los inconvenientes de usar esta fuente de energía son importantes: recursos limitados, no renovables y contaminantes, especialmente con generación de CO2. Además, desde el punto de vista químico, quemar derivados del petróleo supone que estamos gastando miles de compuestos químicos que son las materias primas con las que fabricamos bienes de consumo (principalmente, plásticos y polímeros de infinidad de aplicaciones).
Otra fuente de energía es la electroquímica, donde la energía química de los iones es convertida
en electricidad por medio de reacciones de oxidación-reducción (redox). Este es el fundamento de las pilas y las baterías, que desde hace doscientos años han facilitado nuestras vidas (la primera aplicación tecnológica fue el telégrafo) y que actualmente permiten que muchos dispositivos electrónicos (por ejemplo, los móviles) sean muy pequeños. El futuro de la energía depende del uso de fuentes renovables de energía (por ejemplo, la solar) que convertiremos en electricidad. La química está desarrollando procesos y materiales con lo que se puede aprovechar más eficientemente la energía solar y almacenar de manera adecuada energía eléctrica (pilas, baterías, supercondensadores, células de combustible, etc.).
Protección ambiental y toxicológica. El deterioro medioambiental está estrechamente relacionado con nuestro consumo excesivo de energía. Si conseguimos los objetivos indicados en el apartado anterior, contribuiremos a resolver el problema medioambiental. También es indudable que parte de la culpa de la alta contaminación ambiental se debe al uso excesivo y no adecuado de sustancias químicas. Tristemente, este el peaje que tiene que pagar una sociedad tecnológicamente avanzada. La contaminación química es un tema frecuente en los medios de comunicación. Hace unos años, no éramos tan conscientes de los peligros medioambientales de muchos compuestos químicos, y este conocimiento lo hemos adquirido por investigaciones realizadas por químicos. Muchos compuestos químicos de amplio uso (por ejemplo, pesticidas o detergentes) son beneficiosos en nuestra vida cotidiana, pero el uso de este tipo de sustancias debe hacerse de manera racional y controlada, lo que no siempre ocurre. Si se ponen los medios adecuados, la química
18
Figura 9. La química y los alimentos.
Panel nº 12 de la exposición Entre Moléculas
Educació Química EduQ número 18
(Comisario científico: Bernardo Herradón)
puede contribuir a mejorar la situación medioambiental.
Algunas aportaciones de la química en esta faceta son: a) cuantificación de sustancias químicas en el ambiente; b) contribución a determinar la toxicidad de compuestos químicos y a descubrir el mecanismo de acción biológica (en colaboración con biólogos); c) diseño y síntesis de compuestos químicos con actividad biológica beneficiosa (en la dosis adecuada) que puedan paliar los efectos de otros agentes tóxicos; d) desarrollo de procesos industriales que sean más benignos con el medio ambiente (química verde); e) diseño e implantación de rutas químicas para el tratamiento de residuos (en el caso ideal, el producto final de este tratamiento sería la transformación en compuestos no tóxicos, pero, como esto es difícil de lograr, lo que hacemos es transformar compuestos químicos en otros con la mínima toxicidad); f) investigación de procesos físicos y químicofísicos de separación selectiva de sustancias tóxicas (por ejemplo, desarrollo de membranas y adsorbentes con alta afinidad por compuestos químicos tóxicos que podrían servir para «atraparlos»); g) investigación en procesos de generación de «energía limpia» (por ejemplo, en el diseño de pilas de combustible donde la energía proceda de la combustión del hidrógeno, cuyo producto es solo agua). Es importante tener en cuenta que todo lo que nos rodea en nuestra vida diaria es química, que los seres humanos estamos contaminando continuamente y que la única solución es que los residuos sean separados de manera adecuada para su tratamiento posterior y, cuando sea posible, reciclar. El tratamiento medioambiental empieza en el individuo: tenemos que minimizar el gasto energético, no tirar basura en la calle (en el campo, en el monte, etc.) y las basuras que generemos
en nuestra casa deben ser separadas según las normas de reciclaje y tratamiento. Aunque la situación medioambiental es bastante preocupante, confiamos en revertir la situación y, entre todos (ciudadanos, empresas, gobiernos), tener un planeta más saludable. Deportes y ocio. La química juega un papel importante en el avance deportivo, tanto a nivel profesional como aficionado. Gracias a la química, tenemos métodos y productos para controlar y mejorar la salud del deportista, para la lucha antidopaje, materiales para la práctica deportiva, instalaciones deportivas, etc. Por otro lado, otras actividades relacionadas con el ocio también dependen de la existencia de sustancias químicas.
Productos para nuestro cuidado personal. Todos los productos relacionados con nuestra higiene o con el cuidado de nuestra imagen se deben a la existencia de sustancias químicas. Las industrias químicas de cosmética son de las más potentes del mundo y de las que más invierten en investigación.
Materiales cotidianos. Todos los objetos cotidianos (tejidos, velcro, colorantes, celofán, tintas, piezas de vehículos, electrónica, automóviles, etc.) relacionados con el trabajo, el estudio, el transporte, etc., están fabricados con sustancias químicas.
Tecnología. La química está sintetizando moléculas con propiedades eléctricas, magnéticas, ópticas o mecánicas extraordinarias, con las que se están produciendo materiales para aplicaciones de tecnología muy sofisticada, desde materiales para aeronáutica hasta grandes obras de ingeniería, electrónica, computación, etc.
Soporte científico para explicar fenómenos naturales. La química, como ciencia madura, permite explicar fenómenos como la vida (un conjunto de reacciones químicas) o apoyar las investigaciones en astrofísica.
Conclusiones
En este artículo hemos presentado un breve resumen de los temas tratados en las cuatro ediciones del curso Los avances de la química y su impacto en la sociedad, en que hemos tratado aspectos relacionados con la influencia que los avances en química tienen en la salud humana y animal, en el suministro de alimentos y agua pura, en la agricultura, la energía, el medio ambiente, materiales cotidianos y dispositivos tecnológicos, entre otros. Sin duda, la química es la ciencia que proporciona la mayoría de los materiales cotidianos, siendo imprescindible para nuestro bienestar.
Agradecimientos
Agradecemos la financiación del Plan Nacional de Investigación Científica y Técnica a través del proyecto CTQ2010-19295/BQU.
Bibliografía recomendada
Libros
Atkins, P. W. (2008). Las moléculas. Madrid: Akal.
emsley, J. (1998). Molecules at an exhibition. Oxford: Oxford University Press. (2003). Nature’s building blocks: An A-Z guide to the elements Oxford: Oxford University Press. (2010). A healthy, wealthy, sustainable world . Oxford: Oxford University Press.
HerrAdón, B. (2011). «La (mala) imagen de la química: una benefactora de la humanidad». En: La imatge de la química: Destapa-la! Valencia: Col·legi Major Doctor Peset, p. 19-26. (2012). Los avances de la química Madrid: Libros de la Catarata; CSIC.
lóPez nieto, J. M. (2011). Química verde. Madrid: Libros de la Catarata; CSIC.
mArtín-gAgo, J. A.; Briones, C.; cAstro, E.; serenA, P. A. (2014). El nanomundo en tus manos: Las
Monografia / Divulgació de la química 19 Los avances de la química y su impacto en la sociedad
claves de la nanociencia y la nanotecnología. Barcelona: Crítica. nicolAou, K. C.; montAgnon, T. (2008). Molecules that changed the world Weinheim: Wiley-VCH. vAllet regí, M. (2013). Biomateriales. Madrid: Libros de la Catarata; CSIC.
Artículos
HerrAdón, B. (2011). «La química: situación actual y perspectivas de futuro». Alkaid: Revista Multitemática, n.º 13, p. 16-27. (2011). «La química y las ciencias de la vida». SEBBM, n.º 169, p. 4-6. (2011). «La química y su relación con otras ciencias». Journal of Feelsynapsis, n.º 1, p. 81-86. (2011). «La química: la ciencia central en el siglo xxi» Boletín de la Fundación BBVA, n.º 26, p. 32.
HerrAdón, B.; Pérez, Y. (2014). «La química y la alimentación». Alkaid: Revista Multitemática, n.º 18, p. 32-43.
HerrAdón, B.; Pérez, Y.; mAnn, E. (2012). «La química como herramienta en nanotoxicología». Seguridad y Medio Ambiente, n.º 127, p. 56-67.
Sitios web de interés1 http://www.losavancesdelaquimica. com/. Sitio web donde se aloja la información y el material del curso de divulgación Los avances de la química y su impacto en la sociedad. http://www.madrimasd.org/blogs/ quimicaysociedad/. Blog con material didáctico útil e información sobre la relación entre química y sociedad. http://educacionquimica.wordpress. com/. Blog dedicado a temas relacionados con la enseñanza de la química. http://mascienciapf.blogspot.de/ Especialmente involucrado en
1. Todos los sitios web fueron consultados el 16 de junio de 2014.
aspectos relacionados con la enseñanza, la divulgación y la investigación química.
http://web.educastur.princast.es/ proyectos/fisquiweb/index.htm Sitio dedicado a la enseñanza de la física y la química. http://flagellum.wordpress.com/ Blog de ciencia con especial interés en la frontera entre la química y la biología. http://blogs.nature.com/thescepticalchymist/. Blog de la revista Nature Chemistry con artículos muy variados e interesantes.
http://elblogdebuhogris.blogspot.com. es/. El subtítulo del blog es Un alegato contra la quimifobia. Blog contra todas las falsas creencias sobre el uso de sustancias químicas.
http://www.esepuntoazulpalido.com/ El blog publica artículos científicos de todas las áreas, pero la química es uno de sus temas preferidos. Frecuentemente, los artículos invitan a la reflexión. Destacan especialmente las recomendaciones de lecturas científicas y de historia de la ciencia.
http://isqch.wordpress.com/. Blog del Instituto de Síntesis Química y Catálisis Homogénea (ISQCHUZ-CSIC). Artículos con un alto valor científico.
http://www.facebook.com/todoesquimica2012. Grupo de Facebook donde se enlazan y se comentan artículos de divulgación, historia de la química, biografías de químicos y avances científicos.

Luis Moreno-Martínez
Es licenciado en Química y EU en Divulgación y Cultura Científica. Es
profesor de Física y química de ESO y bachillerato en el colegio Tres Olivos de Madrid. Ha participado en varios proyectos de comunicación social de la ciencia, evaluación educativa y editoriales. Ha colaborado en educación (didáctica e historia de la química) con Bernardo Herradón, en el Instituto de Química Orgánica General del Consejo Superior de Investigaciones Científicas (IQOG-CSIC).

Bernardo Herradón
Es doctor en Ciencias Químicas por la Universidad Complutense de Madrid (1986). Actualmente es investigador científico en el Instituto de Química Orgánica General del Consejo Superior de Investigaciones Científicas (IQOG-CSIC), del que fue director entre 2006 y 2010. Ha investigado en la Universidad de Alcalá, el ETHZürich y la Universidad de Stanford. Sus temas de investigación abarcan un amplio rango de la química orgánica, incluyendo síntesis orgánica, compuestos bioactivos, estructura e interacciones de compuestos aromáticos y péptidos y toxicología computacional. Entre sus objetivos, está la difusión de la cultura científica, especialmente entre estudiantes de ESO y bachillerato, participando en ferias científicas, visitas guiadas, mesas redondas, charlas y cursos de divulgación. Dirige el curso de divulgación Los avances de la química y su impacto en la sociedad y es el comisario científico de la exposición «Entre moléculas», elaborada por el CSIC. Es autor del libro Los avances de la química (2011) y ha sido editor de Anales de Química de la RSEQ entre 2012 y 2014. En julio de 2014 fundó la empresa Gnanomat.
C. e.: b.herradon@csic.es
20
Educació Química EduQ número 18
¿Depurar el agua en Almería? ¿Para qué? El uso de las controversias socioquímicas en la prensa
Depurar l’aigua a Almeria? Per què? L’ús de les controvèrsies socioquímiques a la premsa
Water treatment in Almeria? Why? The socio-chemical issues in newspapers
M.ª Rut Jiménez Liso y Naira C. Díaz Moreno / Universidad de Almería. Área de Didáctica de las Ciencias Experimentales
resumen

Las difíciles relaciones entre científicos y periodistas para entenderse mutuamente sirven de punto de partida para construir una «divulgación química» que se transforme en una «comunicación científica como proceso educativo», problematizada y que ponga en conflicto los mitos, creencias o concepciones alternativas de la sociedad, escolar o no. Las noticias sobre depuración de agua nos permiten transformar el consenso en controversia y reflexionar sobre las implicaciones para periodistas y docentes.
palabras clave
Divulgación química, controversias sociocientíficas, depuración de agua.
resum
Les difícils relacions entre científics i periodistes per entendre’s mútuament serveixen de punt de partida per construir una «divulgació química» que es transformi en una «comunicació científica com a procés educatiu», problematitzada i que posi en conflicte els mites, creences o concepcions alternatives de la societat, escolar o no. Les notícies sobre depuració d’aigua ens permeten transformar el consens en controvèrsia i reflexionar sobre les implicacions per a periodistes i docents.
paraules clau
Divulgació química, controvèrsies sociocientífiques, depuració d’aigua.
abstract
The mutual misunderstandings between scientists and journalists serve as a starting point to build a «chemical divulgation» which was transformed into a «science communication as an educational process», problematized conflicts myths, beliefs or alternative conceptions of society, be they scholarly or not. News about water purification allows us to transform the consensus into controversy and reflect on the implications for journalists and teachers.
keywords
Communicating chemistry, socio-scientific issues, water purification.
Introducción
Gran parte de la información científico-tecnológica que recibi-
mos el público no escolar nos llega a través de la prensa escrita (Pro, 2005), por lo que esta juega
un papel fundamental a la hora de aportar información a la opinión pública sobre temas relacio-
21 ISSN 2013-1755, SCQ-IEC Educació Química EduQ número 18 (2014), p. 21-29
DOI: 10.2436/20.2003.02.131 http://scq.iec.cat/scq/index.html
nados con ciencia y tecnología (Dimpoulos y Koulaidis, 2002) y genera o refuerza la imagen que sobre la ciencia y la tecnología tiene el público en general (Campanario, Moya y Otero, 2001).
Actualmente —no siempre fue así (Mans, 2014)—, la imagen habitual de la química en la prensa y en la sociedad suele ser negativa, pues se identifica con contaminación, accidentes químicos, radioactivos o con sustancias nocivas para la salud, incluida la ambiental, como los CFC, agrotóxicos, etc., y, sin embargo, no se relaciona con los procesos para reducir la contaminación o con procesos tan fundamentales como la depuración y potabilización de agua.
Para cambiar esta deteriorada imagen de la química, la divulgación científica no puede reducirse a noticias sobre proyectos conseguidos o nuevos descubrimientos que son de difícil comprensión por parte del público lego, sino que debería poner en conflicto esa imagen y todos aquellos «mitos» que sobre la química manejamos. En definitiva, utilizando un argot de educación científica, la prensa debería aprovechar las concepciones alternativas para plantear «conflictos», de manera que generaran interés por seguir leyendo la noticia y la satisfacción de aprender mientras se resuelven.
En el presente artículo, por un lado, describiremos las difíciles relaciones entre científicos y periodistas para entenderse; por otro lado, la oportunidad desaprovechada al mostrar una imagen consensuada en las noticias científicas en prensa, y, por último, una propuesta de mejora utilizando las controversias sociocientíficas (y socioquímicas) como motor de cambio de esa imagen denostada de la química y de cambio de concepciones alternativas comunes. Por tanto, puede tener interés para periodistas, para científicos y
para los docentes que quieran incorporar noticias científicas en sus clases.
Divulgación científica: la difícil relación entre ciencia y prensa
La difícil relación entre los principales agentes de divulgación científica (científicos y periodistas) se hace evidente por su insatisfacción ante el objetivo y los resultados de la divulgación científica:
— Para unos (científicos), esta insatisfacción proviene, por un lado, del hecho que la divulgación queda reducida a cuestiones publicitarias, como la difusión de los proyectos I+D+i concedidos y, en el mejor de los casos, de algún logro o transferencia de resultados finales a empresas relacionadas con el proyecto, pero, sobre todo, porque, cuando se leen, ven tergiversadas sus palabras en frases incoherentes e incluso erróneas —método de depuración de aguas que «genera contaminantes en una cuantía irrisoria» (Jiménez Liso, Hernández-Villalobos y Sánchez, 2010)—, porque no saben «cómo hacerse entender por los periodistas» (Montero, 2014), por la injustificada fijación con «para qué sirve» o «cuánto cuesta», reforzando la «falacia de la investigación rentable» (LópezNicolás, 2013), etc.
— Los otros (periodistas) no suelen enorgullecerse del producto que generan, pues sufren para explicar algo que les resulta claramente incomprensible y son incapaces de «salirse del guion» o generar noticias propias, pues raramente reconocen lo que en el argot se denomina percha, es decir, ese suceso al que agarrarse para generar opinión, formación o entretenimiento. Por ello, cada vez más, solicitan que sean los propios científicos quienes les escriban frases y párrafos que quieran que aparezcan en el texto; de ahí que estas labores, en los periódi-
cos locales, suelan otorgarse a los últimos en llegar (y estos estén deseando ascender profesionalmente para huir de tamaña tarea).
Además de estas difíciles relaciones entre los dos principales actores de la divulgación científica, con el término divulgación se suele poner el énfasis en la propagación y extensión de los resultados de las investigaciones científicas, cuyo objetivo parece reducirse a granjearse a la opinión pública para informar sobre lo que se trabaja o para qué (González y Jiménez Liso, 2005). Como señala Hernández (2013), términos como divulgación, diseminación y transferencia de resultados se están convirtiendo en habituales en la jerga investigadora, denotando un modelo de transmisión del conocimiento «de los que saben a los que no».
¿Centrados en los emisores/mensajes o en la comprensión de los receptores?
Como sucede en educación, el arcaico modelo transmisivo es desacreditado desde numerosas investigaciones educativas por la pasividad que reconoce en los receptores y la autenticidad en los transmisores (Bray, France y Gilbert, 2012), pero, sobre todo, por su ineficacia, al considerar que los receptores del mensaje (educativo, científico o periodístiEn definitiva, utilizando un argot de educación científica, la prensa debería aprovechar las concepciones alternativas para plantear «conflictos», de manera que generaran interés por seguir leyendo la noticia y la satisfacción de aprender mientras se resuelven
22 Educació Química EduQ número 18
co) son como vasos vacíos que llenar con la fuente de la sabiduría de los emisores (docentes, científicos o periodistas). Bajo esta concepción del aprendizaje, la mejora de la divulgación científica consistiría en mejorar la calidad del mensaje transmitido, por ejemplo, con una buena narrativa y con buenos «cuentistas» (en su segunda acepción de la RAE, ‘persona que suele narrar o contar cuentos o relatos breves’), al igual que la mejora de la educación química consistiría en hacer más entretenidas las clases con una buena puesta en escena.
Ni siquiera esta arcaica concepción del aprendizaje era manifestada a comienzos del siglo xx por el «comunicador» de la ciencia y la tecnología y premio Nobel de Literatura José Echegaray, pues ya solo el término de su principal libro, vulgarización, muestra otras connotaciones hacia lo común y «vulgar» (de vulgo, ‘el común de la gente popular’), es decir, hacia las características de la audiencia y no tanto del mensaje a emitir o de la sabiduría del emisor. En este sentido, aprovechando sus dotes de dramaturgo, es fácil encontrar en sus escritos de Vulgarización científica la estructura argumental teatral (exposición, trama/nudo y desenlace) que engancha y cobra sentido para los lectores desde el principio hasta el final del artículo. Un ejemplo de ello es El ovillejo de bramante y la locomotora, para explicar el funcionamiento de la locomotora con el ovillo de diez metros de hilo (de bramante) que un muchacho hizo en una estación (Echegaray, 1910):
El resultado de mis meditaciones fue este: que la locomotora existe [...] sólo porque el chicuelo pudo, con los diez metros de bramante, hacer un ovillejo y llevárselo en el puño cerrado.
Tras explicar cómo funciona una máquina de vapor, plantea:
Aquí invito amistosamente a mi hipotético lector a que suelte el artículo por unos cuantos minutos, á ver si adivina qué relación puede existir entre la posibilidad de una locomotora y la posibilidad de que 20 metros de bramante quepan en la mano de un chico.
Traemos a colación este ejemplo porque no solo ilustra cómo contextualizar con fenómenos próximos y conocidos por los lectores, sino que, además, utiliza la intriga, plantea un problema e invita a resolverlo antes de encontrar la solución en las siguientes líneas. Muchos docentes reconocerán esta estrategia como propia en sus clases de ciencias, ¿no?
Para lograr esto, es necesario un cambio en las finalidades del proceso (educativo o divulgador) de poner el foco en qué mensaje se quiere transmitir o en el conocimiento experto de los científicos hacia el foco de los receptores del mensaje, de lo que saben, de lo que desconocen o de las concepciones alternativas a las científicas que poseemos. Como señalan los diez formadores de comunicadores científicos de Nueva Zelanda que participaron en la investigación de Bray, France y Gilbert (2012), «no importa cómo es de complicado un concepto, la audiencia puede comprender las grandes ideas», que relacionamos con las de Harlen (2010).
Este cambio de mentalidad, en términos educativos, centrado en el alumnado en vez de centrado en el contenido a enseñar o en el profesorado, ya se reconoce en la propia denominación, pues actualmente se incide más en la comunicación de la
ciencia (o comunicación científica) para destacar la importancia de que haya hecho comunicativo, es decir, que el mensaje llegue del emisor al receptor y no se corte esa comunicación, interacción o diálogo.
Para ello, se hace imprescindible un conocimiento mutuo de todos los agentes del proceso (científicos, periodistas, educadores, público en general) y de herramientas avaladas por la investigación didáctica que realmente funcionen, como las destacadas en el texto de Echegaray: contextualizar, problematizar, dejar espacio para pensar, etc., pero también el conocimiento de la audiencia: de sus «mitos», sus creencias y las concepciones alternativas más habituales para ponerlas en conflicto.
Llamamos controversias sociocientíficas a aquellas controversias sociales que tienen su base en nociones científicas relacionadas también con aspectos éticos, políticos o ambientales
Las controversias sociocientíficas: ¿oportunidades perdidas?
Llamamos controversias sociocientíficas a aquellas controversias sociales que tienen su base en nociones científicas (Solbes y Torres, 2012) relacionadas también con aspectos éticos, políticos o ambientales (Jiménez Aleixandre, 2010). Surgen debido a la compleja relación existente entre ciencia y sociedad (Kolstø, 2001), por un hecho frontera entre ambas y por las discrepancias o diferencias de opinión entre periodistas, ciudadanos y/o científicos.
La característica compleja del hecho frontera impide que exista una única solución válida y racio-
Monografia / Divulgació de la química 23
el
en
¿Para qué? El uso de las controversias socioquímicas en la
¿Depurar
agua
Almería?
prensa
Las noticias científicas aparecen habitualmente sin conflicto alguno, manifestando un consenso general que no favorece ni a científicos ni a periodistas/medios y que no genera interés en el público
nal o simple, lo que genera controversia y ríos de tinta en prensa o en televisión.
Suelen ser producto de la «ciencia en construcción» (science in the making), que ejerce un impacto social transcendiendo los límites científicos y en la que terminan interviniendo empresas privadas y opinión pública, que son las que, en definitiva, financian los proyectos científicos que las generan (Kolstø, 2001). Cuando se genera una controversia sociocientífica, el tratamiento de la ciencia en prensa se transforma ocupando el protagonismo, aumentando la presencia de noticias científicas, aunque no varíen las referencias en portada o el tamaño de las noticias (Díaz, 2013).
Este protagonismo o difusión «extra» las convierte en una excelente oportunidad para hacer pensar a la sociedad sobre las «grandes ideas» y poner en conflicto sus mitos y concepciones alternativas, favoreciendo así la educación científica de la población no necesariamente escolar.
En estos estados de controversia, los «no expertos» suelen tener el papel de interlocutores y no de destinatarios pasivos de los contenidos científicos (Lorenzet, 2013), con lo que la finalidad transmisiva viene ya modificada por el propio conflicto generado entre ciencia, prensa y sociedad. Así, dado el protagonismo que generan, las controversias cambiarán las reglas de la comunicación pública
de la ciencia, volviéndola más articulada y plural (Lorenzet, 2013).
Por tanto, los comunicadores científicos deben aprovechar las controversias surgidas, porque, en estado no controvertido o consensuado (Díaz, 2013), las noticias científicas aparecen habitualmente sin conflicto alguno, manifestando un consenso general que no favorece ni a científicos ni a periodistas/medios y que no genera interés en el público, que no se dota de argumentos para futuras controversias. En estos estados consensuados, la comunicación científica suele aparecer de forma taxativa y factual (Alcíbar, 2007), alejándose de una imagen problematizadora de la ciencia (Díaz y Jiménez Liso, 2012). Mostraremos un ejemplo de ello en el siguiente apartado, sobre la depuración de aguas en la prensa almeriense.
Depuración de aguas: del consenso a la controversia sociocientífica
Como hemos señalado en el apartado anterior, en estados no controvertidos, el consenso, la aproblematización de la cien-
cia, suele ser el tratamiento habitual de las noticias. Utilizamos como ejemplo de «divulgación aproblemática» la difusión en la prensa local almeriense de la concesión de un proyecto I+D+i de depuración de aguas residuales (FOTOMEM) cuyo análisis de la divulgación fue estudiado por Jiménez Liso, Hernández Villalobos y Sánchez Pérez (2010).
Señalamos en el recuadro el fragmento que más rechazo produjo entre los científicos implicados en el proyecto, pues, por un lado, vieron reducido a esa frase ininteligible el objetivo del proyecto y la innovación que suponía la combinación de fotocatálisis solar con tratamiento biológico, cuando el esquema era «sencillo» para ellos (fig. 2), y, por otro lado, no comprendían cómo después de lo explicado a la periodista (fig. 2 y 3) aparecía en los medios que su proceso de depuración «genera contaminantes en una cuantía irrisoria».
La periodista, además de no comprender lo que de manera tan simplificada querían transmitirle los cien-

24
Educació Química EduQ número 18
Figura 1. Noticia divulgativa del proyecto FOTOMEM (CIESOL) en Almería Actualidad (3 marzo 2009).

La prensa no debería solo hacerse eco de la financiación y la concesión de proyectos, sino también promover esa participación activa, formando a la población (e informando) para integrarla en los procesos de toma de decisiones políticas en materia de aguas y ayudando a la legislación a reducir los vertidos incontrolados
tíficos, no encontró «percha» alguna para realizar algo similar a lo planteado por Echegaray con El ovillejo de bramante... para contextualizar o problematizar. Sin embargo, los vertidos salvajes de aguas tóxicas que sufren nuestros ríos y mares hacen intuir una concepción bastante extendida, que es la de pensar ¿para qué pagar por depurar, si todas las aguas van al mar? La controversia sociocientífica está servida.
En el contexto de la Unión Europea y, por tanto, también en
España, la directiva marco del agua (Directiva 2000/60/CE, del Parlamento Europeo y el Consejo, de 23 de octubre de 2000) regula la calidad de las aguas para su consumo (humano y agroindustrial), así como la depuración de las aguas residuales.
Esta directiva obliga a las administraciones competentes en materia de aguas a la promoción de la participación activa de la población, entre otras obligaciones, para evitar una participación reactiva como la de Gamonal, en Burgos, con el derroche de un
proyecto paralizado por la población después de su fase de exposición pública.
La prensa no debería solo hacerse eco de la financiación y la concesión de proyectos como FOTOMEM, sino también promover esa participación activa, formando a la población (e informando) para integrarla en los procesos de toma de decisiones políticas en materia de aguas y ayudando a la legislación a reducir los vertidos incontrolados desde el conflicto hasta mitos como pensar que no es necesario depurar si el agua va
Monografia / Divulgació de la química 25
¿Depurar el agua en Almería?
¿Para qué?
El uso de las controversias
socioquímicas en la prensa
Figura 2. Esquema del proyecto FOTOMEM.
Figura 3. Procesos de biodegradación por fotocatálisis solar y fango activo del proyecto FOTOMEM.
La formación de los comunicadores científicos, ya provengan de ciencias, de comunicación o de educación, debería tener los mismos elementos que la formación en didáctica de las ciencias experimentales: contextualizado, problematizado, explicaciones, pruebas, análisis y evaluación de las pruebas a la luz de modelos, es decir, un proceso de indagación
al mar, que produce uno de los problemas ambientales relevantes, según datos del Ecobarómetro (contaminación de playas, mares y ríos).
Otro «mito» habitual en la población almeriense, en concreto, la relacionada con la agricultura, es la percepción del «déficit hídrico» en la provincia. Esta percepción, proveniente de la idea del agua como negocio (Arrojo, 2006), no es contrapuesta
a la reconocida «eficiencia» de este «recurso escaso» (fig. 4) por parte de la agricultura, motor de desarrollo económico de la provincia durante los últimos años.
Estos hechos, junto con el debate creado con la derogación del Plan Hidrológico Nacional y el trasvase del Ebro en el 2004, hacen que el tema del agua en la provincia pueda constituir una controversia sociocientífica y un buen ejemplo que puede utilizarse para divulgar planteando los problemas que dicha controversia suscita llevando a cabo una «divulgación a través de controversias».
Sin poner en conflicto los mitos, creencias o ideas de la población tanto en relación con los vertidos como en relación con la «escasez de agua», difícilmente podremos entender el coste (o la inversión, como prefiramos) que suponen para las arcas públicas tanto los proyectos de investigación que economicen la depuración como para los «propios bolsillos», ya seamos agricultores o usuarios en general, las obras de tratamiento de aguas (fig. 5).


Implicaciones para la comunicación química
Las controversias latentes sobre la temática del agua, que solo se convierte en protagonista cuando el público lo demanda (como el ejemplo de las manifestaciones para evitar la privatización en Alcázar de San Juan), deberían aprovecharse para construir conocimiento científico y fomentar la participación activa que demanda la directiva europea.
Esto tiene implicaciones directas para la formación de «comunicadores científicos».
Contribuimos con esto al estudio de Bray, France y Gilbert (2012) de identificar los elementos esenciales de la comunicación científica efectiva, pues estamos analizando el proceso de comunicación científica como el proceso de enseñanza-aprendizaje científico que es y, por tanto, la formación de los comunicadores científicos, ya provengan de ciencias, de comunicación o de educación, debería tener los mismos elementos que la formación en didáctica de las ciencias experimentales (Martínez Chico, López Gay y Jiménez Liso, en prensa): contextualizado, problematizado, explicaciones, pruebas, análisis y evaluación de las pruebas a la luz de
26
Figura 4. Extracto de una noticia relacionada con la eficiencia del agua en Almería en Ideal (28 junio 2008).
Figura 5. Extracto de una noticia relacionada con la controversia del agua en La Voz de Almería (19 febrero 2008).
Educació Química EduQ número 18
modelos; en definitiva, un proceso de indagación centrado en modelos. Por tanto, tiene implicaciones directas para la didáctica de las ciencias experimentales, que debe dar el salto del análisis crítico de la divulgación científica actual y asumir como objeto de investigación y docencia la formación de comunicadores científicos para ofrecer los ya consolidados resultados de años de investigación didáctica, pues, en caso contrario, seguiremos teniendo en los medios de comunicación a un enemigo poderoso que seguirá reforzando o induciendo concepciones alternativas (Jiménez Liso et al., 2000) que tanto tiempo, esfuerzo y trabajo nos lleva poner en conflicto en el contexto escolar.
Sirva de ejemplo la polémica suscitada por un anuncio de una conocida marca de pan de molde protagonizado por un conocido divulgador científico. En el anuncio se refuerza la idea de que la química, representada con los matraces y vasos de precipitado de conservantes artificiales/aditivos que se ven en la fig. 6, es sinónimo de artificial y, por tanto, perjudicial, frente al 100 % natural como beneficioso para el organismo del horneado del pan con levadura, aceite, harina y agua. Esta contraposición puede «tirar por
tierra» en unos veinte segundos el ingente trabajo de numerosos docentes que, al igual que Izquierdo et al. (2012), utilizan la fabricación del pan para aprender química en infantil o primaria, y más aún procediendo del prestigio como divulgador de la ciencia de quien lo protagoniza.
Estos problemas sociocientíficos en los medios de comunicación son las controversias sociocientíficas que deben tener su presencia y espacio reservado en las aulas de ciencias (y de sociales) no solo como pretexto, sino también con el objetivo de promover la formación de ciudadanos y ciudadanas reconociendo la ciencia como «producto social fruto de la actividad humana»
También tiene consecuencias para la formación científica en edad escolar, pues obliga necesariamente a incluir el análisis crítico de la comunicación científica

(también la que aparece en la publicidad) y a poner en conflicto la ciencia neutral y objetiva para sustituirla por una educación científica más comprometida, que facilite la reflexión y la crítica, que fomente la toma decisiones y, por último, que atienda a las necesidades ciudadanas y a sus problemas, al igual que la «ciencia de los científicos» se construye partiendo de problemas e interrogantes (Pro, 2012). Estos problemas sociocientíficos en los medios de comunicación son las controversias sociocientíficas que deben tener su presencia y espacio reservado en las aulas de ciencias (y de sociales) no solo como pretexto, sino también con el objetivo de promover la formación de ciudadanos y ciudadanas (Sadler, 2004; Sadler, 2009; Sadler, 2011; Zeidler et al., 2005), reconociendo la ciencia como «producto social fruto de la actividad humana donde existen aciertos y errores, consensos y discrepancias» (Pro, 2012), puesto que sus características la hacen muy útil para crear situaciones ricas para el aprendizaje de aspectos que influyen en nuestras decisiones (España y Prieto, 2010) y capacitar a los estudiantes para una toma responsable de las mismas.
En un trabajo previo (Díaz y Jiménez Liso, 2012), analizamos los trabajos didácticos de uso de controversias en el aula de ciencias y encontramos que la implementación de las controversias, la mayoría de ellas para la educación secundaria, ofrece a los docentes escasa variedad de actividades, pues, de las diecisiete secuencias encontradas en la literatura didáctica, ocho se basaban en el debate de opinión, cuatro proponían un juego de rol o de simulación, una miniQuest y tres se caracterizaban por la búsqueda de información adicional a las noticias (prensa o televisión) utilizadas. Además de ello, debemos
Monografia / Divulgació de la química 27
el
¿Para
El
de las controversias socioquímicas en la
¿Depurar
agua en Almería?
qué?
uso
prensa
Figura 6. Fotograma de un anuncio publicitario de pan de molde.
tratar de aumentar las controversias sociocientíficas para cada contenido trabajado y diversificar las actividades en las que ayudemos a los estudiantes a comprender la controversia, los diferentes posicionamientos y el conocimiento científico implicado, pero también a ponerse en el papel de los periodistas al construir noticias controvertidas usando mitos y creencias —en definitiva, las concepciones alternativas que tiene la población (y los estudiantes también)—, lo que desarrollará conjuntamente las competencias en comunicación lingüística, científica y las de posibles profesiones como divulgadores científicos, ampliando «la diversidad de miradas para que ellos mismos se vayan forjando la suya propia» (Izquierdo et al., 2012).
Referencias
AlcíBAr, M. (2007). Comunicar la ciencia: La clonación como debate periodístico. Madrid: Consejo Superior de Investigaciones Científicas.
Arrojo, P. (2006). «La evolución en la planificación y gestión del agua. El desplazamiento desde la oferta hasta la demanda». En: AIGUA: Una nova política a la Comunitat Valenciana. Sostenibilitat i gestió hídrica [en línea]. S. ll.: s. n. <http://www. unizar.es/fnca/includes/noticias/print74.html>. [Consulta: 29 abril 2014].
BrAy, B.; FrAnce, B.; gilBert, J. K. (2012). «Identifying the essential elements of effective science communication: what do the expert says?». International Journal of Science Education, vol. 2, n.º 1, p. 23-41.
cAmPAnArio, J. M.; moyA, A.; otero, J. C. (2001). «Invocaciones y usos inadecuados de la ciencia en la publicidad». Enseñanza de las Ciencias, vol. 19, n.º 1, p. 45-56.
díAz, N. (2013). Determinación de una controversia sociocientífica a nivel local: El caso del agua como recurso natural en la prensa almeriense. Tesis doctoral. Almería: Universidad de Almería. [En prensa]
díAz, N.; jiménez liso, M.ª R. (2012). «Las controversias sociocientíficas: temáticas e importancia para la educación científica». Revista Eureka sobre Enseñanza y Divulgación de las Ciencias, vol. 9, n.º 1, p. 54-70.
dimPoulos, K.; koulAidis, V. (2002). «The socio-epistemic constitution of science and technology in the Greek press: an analysis of its presentation». Public Understanding of Science, n.º 11, p. 225-241.
ecoBArómetro (2004). Web de la Consejería de Medio Ambiente y Ordenación del Territorio [en línea]. Sevilla: Junta de Andalucía. <http://www.juntadeandalucia.es/medioambiente/site/portalweb/menuitem. 7e1cf46ddf59bb227a9ebe20551 0e1ca/?vgnextoid=3f6f82e0851 d4010VgnVCM1000000624e50a RCRD&vgnextchannel=f83bc1 7a45b05310VgnVCM1000001325e50aRCRD> [Consulta: 29 abril 2014]. — (2010). Web de la Consejería de Medio Ambiente y Ordenación del Territorio [en línea]. Sevilla: Junta de Andalucía. <http:// www.juntadeandalucia.es/ medioambiente/site/portalweb/menuitem.7e1cf46ddf59b b227a9ebe205510e1ca/?vgnext oid=3f6f82e0851d4010VgnVCM 1000000624e50aRCRD&vgnext channel=f83bc17a45b05310Vg nVCM1000001325e50aRCRD> [Consulta: 29 abril 2014].
ecHegArAy, J. (1910). Vulgarización científica. Madrid: Tela.
esPAñA, E.; Prieto, T. (2010). «Problemas sociocientíficos y enseñanza-aprendizaje de las ciencias». Investigación en la Escuela, n.º 71, p. 17-24.
gónzAlez gArcíA, F.; jiménez liso, r (2005). «Escribir ciencia para enseñar y divulgar o la ciencia en el lecho de Procusto». Alambique: Didáctica de las Ciencias Experimentales, n.º 43, p. 8-20.
HArlen, W. (2010). Principles and big ideas in science education Hatfield: ASE.
H ernández , M. I. (2013). DESIRE project: Report on the workshop for project managers [en línea]. Bruselas: European Schoolnet: European Network of Science Centres and Museums; Florencia: Istituto Nazionale di Documenta-zione, Innovazione e Ricerca Educativa; Cerdanyola del Vallès: Universitat Autònoma de Barcelona; Copenhague: Danish Science Communication. <http://desire.eun. org/> [Consulta: 28 abril 2014].
izquierdo, M. [et al.] (2012). «El impulso lo dan las células». En: Química en infantil y primaria: Una nueva mirada. Barcelona: Graó, p. 75-102.
jiménez AleixAndre, M. P. (2010). 10 ideas clave: Competencias en argumentación y uso de pruebas. Barcelona: Graó.
jiménez liso, M.ª R.; Hernández villAloBos, L.; lAPetinA, J. (2010). «Dificultades y propuestas para utilizar las noticias científicas de la prensa en el aula de ciencias». Revista Eureka sobre Enseñanza y Divulgación de las Ciencias, vol. 7, n.º 1, p. 107-126.
jiménez liso, M.ª R.; Hernández villAloBos, L.; sáncHez Pérez, J. A. (2010). «Los traductores didácticos y el diálogo entre ciencia y sociedad: una oportunidad para la DCE». En: XXIV Encuentros de Didáctica de las Ciencias Experimentales. Baeza: Universidad de Jaén.
jiménez liso, M.ª R.; mAnuel, E. de; gonzález, F.; sAlinAs, F. (2000).
28
Educació Química EduQ número 18
«La utilización del concepto de pH en la publicidad y su relación con las ideas que manejan los alumnos: aplicaciones en el aula». Enseñanza de las Ciencias, vol. 18, n.º 3, p. 451-461.
kolstø, S. D. (2001). «Scientific literacy for citizenship: tools for dealing with the science dimension of controversial socio-scientific issues». Science Education, vol. 85, n.º 3, p. 291-310.
lóPez nicolás, J. M. (2013). «La niña y el huevo». En: Naukas: Ciencia, escepticismo y humor [en línea]. Bilbao: EiTB. <http://www.eitb.tv/es/#/ video/naukasquantum/ 2698453634001/2705653050001/capitulo-27/> [Consulta: 29 abril 2014].
lorenzet, A. (2013). Il lato controverso della tecnoscienza: Nanotecnologie, biotecnologie e grandi opere nella sfera pubblica Bolonia: Il Mulino.
mAns, C. (2014). «¿Aguas minerales radiactivas?». Investigación y Ciencias: SciLogs [en línea], n.º 24, s. p <http://www.investigacionyciencia.es/blogs/fisica-y-quimica/24/posts/aguasminerales-radiactivas-11822> [Consulta: 29 abril 2014].
mArtínez cHico, M.; lóPez gAy, R.; jiménez liso, M.ª R. (2014). «La indagación en las propuestas de formación inicial de maestros: análisis de entrevistas a los formadores de didáctica de las ciencias experimentales». Enseñanza de las Ciencias, vol. 32, n.º 3, p. 591-608. montero, J. M. (2014). «Relaciones con los medios. ¿Cómo logro que me entienda un periodista?». En: II Jornada de Divulgación Científica DivulgA3 [en línea]. Córdoba: Universidad de Córdoba: Campus de Excelencia Internacional Agroalimentario; Madrid: Fundación Española para la
Ciencia y la Tecnología. <http://cms.ual.es/idc/groups/ public/@serv/@otri/documents/documento/documento247programadivulga3.pdf> [Consulta: 29 abril 2014].
Pro, A. de (2005). «Presentación de la monografía “La enseñanza no formal de las ciencias”». Alambique, n.º 43, p. 5-8.
— (2012). «Las implicaciones sociales del conocimiento científico y tecnológico forman parte de este y, por lo tanto, de su enseñanza». En: PedrinAci, A. (coord.). 11 ideas clave: El desarrollo de la competencia científica Barcelona: Graó, p. 171-195.
sAdler, T. D. (2004). «Informal reasoning regarding socio-scientific issues: a critical review of the literature». Journal of Research in Science Teaching, vol. 41, n.º 4, p. 513-536.
— (2009). «Socio-scientific issues in science education: labels, reasoning, and transfer». Cultural Studies in Science Education, n.º 4, p. 697-703.
— (2011). «Situating socio-scientific issues in classrooms as a means of achieving goals of science education». En: sAdler, T. D. (ed.). Socio-scientific issues in the classroom: Teaching, learning and research. Dordrecht; Nueva York: Springer, p. 1-9. sAdler, T. D.; zeidler, D. L. (2009). «Scientific literacy, PISA, and socio-scientific discourse: assessment for progressive aims of science education». Journal of Research in Science Teaching, vol. 46, n.º 8, p. 909-921.
solBes, J.; torres, N. (2012). «Análisis de competencias de pensamiento crítico desde el aborde de las cuestiones sociocientíficas: un estudio en el ámbito universitario». Didáctica de las Ciencias Experimentales y Sociales, n.º 26, p. 247-269.
zeidler, D. L.; sAdler, T. D.; simmons, M. L.; Howes, E. V. (2005).
«Beyond STS: a research-based framework for socio-scientific issues education». Science Education, n.º 89, p. 357-377.

M.ª Rut Jiménez Liso
Es profesora de Didáctica de las ciencias experimentales en la Universidad de Almería. Actualmente participa como docente en varios títulos de grado y másteres relacionados con la educación ambiental y con la formación del profesorado de ciencias. Sus principales líneas de investigación están relacionadas con la indagación centrada en modelos, la química cotidiana y la formación de maestros en ciencias. También dirige trabajos relacionados con las noticias y las controversias sociocientíficas y sus aplicaciones didácticas (http://scholar.google.es/ citations?hl=es&user=-2IUAm4AAAAJ). Pertenece a la Directiva de APICE y es miembro de ESERA. C. e.: mrjimene@ual.es

Naira C. Díaz Moreno
Becaria posdoctoral del área de Didáctica de las Ciencias Experimentales en la Universidad de Almería. Licenciada en Farmacia por la Universidad de Granada. Es doctora en Investigación Didáctica y profesora en el grado de Maestro. Su campo principal de investigación está centrado en las controversias sociocientíficas. C. e.: naira.diaz@gmail.com
Monografia / Divulgació de la química 29
el
en Almería? ¿Para qué? El uso de las controversias socioquímicas en la prensa
¿Depurar
agua
«The periodic table of videos»: an excellent bridge between university research and the high school chemistry classroom
«The periodic table of videos»: un excel·lent pont entre la recerca universitària i la docència a secundària
Martyn Poliakoff / University of Nottingham
Samantha Tang / University of Nottingham
Brady Haran / Independent film-maker
Pep Anton Vieta / Universitat de Girona
abstract

Teachers and professors know that excitement within the class and school lab is a key factor for promoting vocations. With this article we want to show an interesting project developed from the University of Nottingham that has this objective. «The periodic table of videos» (PTOV) has become an excellent bridge between university research and the high school chemistry classroom. This proposal aims to increase scientific vocations in students and give a better view of chemistry and scientific culture in society.
keywords
Education, videos, periodic table. resum
Els professors saben que la motivació a classe i al laboratori és un factor clau per a la promoció de les vocacions científiques. Amb aquest article volem mostrar un interessant projecte desenvolupat a la Universitat de Nottingham amb aquest objectiu. «The periodic table of videos» (PTOV) s’ha convertit en un excel·lent pont entre la recerca universitària i l’aula de química a secundària. Aquesta proposta té com a objectiu fomentar vocacions científiques, així com millorar la visió de la química i incrementar la cultura científica en la societat.
paraules clau
Educació, vídeos, taula periòdica.
It is known that society often takes a negative view of chemistry and perceives the scientific research conducted in universities as something distant. Over the last decade, in our country, we have noticed a steady decrease in the number of students enrolled in the degree of Chemistry in universities. One of the reasons for that is that the number of students choosing
the scientific itinerary in high schools has also progressively decreased. This trend was not specific for our countries, but also for other regions of Europe. How could we combat this lack of interest?
Teachers and professors know that excitement in the class and school lab is a key factor for promoting vocations, so several new actions were promoted, from the use of recreational chemistry
resources in the class to the creation of blogs and the addition of videos about interesting and amazing aspects of chemistry. These proposals aim to increase scientific vocations in students and give a better view of chemistry and scientific culture in society. Thanks to them, we can see a glimmer of hope in reversing that downward trend. One of these interesting projects is «The perio-
ISSN 2013-1755, SCQ-IEC Educació Química EduQ número 18 (2014), p. 30-33 DOI: 10.2436/20.2003.02.132 http://scq.iec.cat/scq/index.html 30
dic table of videos» (PTOV) [1]. From the University of Nottingham, this project, developed by the video journalist Brady Haran and Prof. Martyn Poliakoff and colleagues, has become an excellent bridge between university research and the high school chemistry classroom.
Background
«I wanted to show what real scientists are like and how they work». With this sentence found on his Test Tube web page [2], the BBC-trained video journalist Brady Haran presented this project to the public. Test Tube started in September 2007, when Haran was appointed filmmaker-in-residence for Nottingham Science City, and it now consists of more than four hundred videos covering topics in chemistry, physics, astronomy and mathematics, to name but a few.
Test Tube became the cradle of several independent projects such as Sixty Symbols [3], Numberphile [4] or Deep Sky Videos [5] and, obviously, PTOV.
PTOV began in June 2008. The project was devised by Brady Haran and features chemists from the University of Nottingham led by Prof. Martyn Poliakoff, The Professor. Of course, the other stars of the project are the elements and the major protagonist is chemistry.
The school and high school students that have the privilege of visiting the School of Chemistry at the University of Nottingham can watch amazing chemical demonstrations performed live by Dr. Pete Licence, Dr. Samantha Tang or Prof. Poliakoff or other colleagues. Since it is not possible to meet all audiences in person, the enthusiasm of these researchers for science has been captured on film with the production of PTOV. This is a series
of short online videos for each of the elements in the periodic table (fig. 1). The runaway success of these, and overwhelming demand from viewers across the world, has resulted in the production of other additional video series that respond to current science news stories, tie in to seasonal events and include molecules of general interest.
In addition to one hundred and twenty videos about the elements themselves, some of which have been updated with newer
The school and high school students that have the privilege of visiting the School of Chemistry at the University of Nottingham can watch amazing chemical demonstrations performed live by Dr. Pete Licence, Dr. Samantha Tang or Prof. Poliakoff or other colleagues

Figure 1. The PTOV homepage with the current nine regular presenters. Clicking on each element opens a link to the video about it.
versions, special ones were produced to reflect chemistry in the news: the helium leak at the Large Hadron Collider, the award of Nobel prizes or the Deepwater Horizon oil spill disaster. A few have been more light-hearted, such as «Pumpkins at Halloween» or «Which element for Christmas?». In 2010, with funding from the Engineering and Physical Sciences Research Council (EPSRC) in the United Kingdom, the team began uploading videos about molecules under the title «Molecular videos». They have also made «road trip» films to destinations such as Ytterby (where the first rare earths were discovered), Darmstadt (birthplace of some of the superheavy elements), Brazil, Australia (one
video was even filmed on Sydney’s Bondi beach!) and to the United States, Ethiopia and India to meet young chemists. Maybe the greatest adventure was the journey to Everest basecamp, where Brady climbed with a kettle and a thermometer. The aim of the trek was to demonstrate that the boiling point of water became lower as the team climbed higher, and the result was one of the most beautiful videos of the entire project. PTOV has become one of the most interesting projects about public engagement of chemistry that we can find nowadays on the web. It is a very useful tool for high school teachers and the videos are used in classrooms all over the world.
Monografia / Divulgació de la química 31 «The periodic table of videos»: an excellent bridge between university research and the high school chemistry classroom
A 2.0 periodic table
This is a 2.0 project and not only in the sense of «using social networks» [6, 7, 8, 9], but also for the physical feedback established between the researchers and the viewers of the videos.
The feedback from pupils, teachers, parents and even Nobel Prize winners has been extremely positive and many students have contacted the team to tell them how inspirational and helpful the videos are to their studies. As of April 2014, the number of sub-
In an article published by the team in Science, «the impact of PTOV is best judged qualitatively from the many thousands of comments and unsolicited e-mails received from viewers»
scribers to the PTOV YouTube channel has reached > 413,000 and the videos have been viewed over 57.5 million times. The impact of the PTOV project is discussed in an article published in Nature Chemistry [10]. In order to make the videos as accessible as possible, the team have worked with transcriptors to produce accurate subtitles in English for it. The videos have also been translated into Portuguese and the translation into other languages, like Spanish, is an exciting project for the future.
In an article published by the team in Science [11], «the impact of PTOV is best judged qualitatively from the many thousands of comments and unsolicited e-mails received from viewers». These messages come from students excited by the chemistry they have seen in the videos or from teachers who use them in their classes.
A loyal fan base for PTOV is noticeable. The Professor’s eccentric hairstyle and endless selection of chemistry-themed neckties are some of the icons of this project, and the viewers watch the videos with much more sympathy than a conventional chemistry class. Viewers feel they are watching a «true record» of life in the Chemistry Department. The presenters are real scientists who are often caught off guard, forced to answer unexpected questions from the interviewer. Their hesi-
tations and occasional admissions of ignorance reinforce the bond with the viewers. The videos look professional because they are produced with broadcastquality equipment used by Brady, yet they deliberately retain an amateur flavour and raw appearance (fig. 2).
Now and future after five hundred videos
In November 2013, the PTOV group celebrated the success of five years’ worth of chemistry on


32
Educació Química EduQ número 18
Figure 2. Brady Haran recording at the GSI (Gesellschaft fuer Schwerionenforschung), Darmstadt, Germany, where hassium was first synthesized.
Figure 3. Prof. Martyn Poliakoff in one of the videos of the project.
YouTube with its special five hundredth video.
The celebratory five hundredth video is a round-up some of the series’ very best moments since its launch in 2008. It features impressive explosions, some of Prof. Poliakoff’s classic lines, and lots and lots of bars of gold.
One of the big reasons for the videos’ success is Prof. Poliakoff, as celebrated in the five hundredth video. However, at the start of the project, Brady had no idea how popular The Professor would prove.
«Off camera, The Professor is very humble and almost shy. He doesn’t strike you as a clichéd “internet star”. But in hindsight, it is that humility, combined with great knowledge, which makes him so popular. People can spot a fake, and they know Prof. Poliakoff is the genuine article», says Brady.
In addition to the Poliakoff effect, Brady believes that it is chemistry itself that is the key to the videos’ popularity. He said: «I think that even after five hundred videos, the scientists are still excited to be sharing their love of chemistry. I also think the videos try to be very honest and show what life’s like in a real lab. You don’t see that unvarnished depiction of science too often on TV or in videos. We’ve also been lucky: with so many people making so many videos, you need a little bit of luck on YouTube».
Reaching the five hundredth video doesn’t signal the end. More videos continue to be uploaded, and there will always be new discoveries and new stories about chemistry. Despite having achieved the initial aim of making a video about each element in the periodic table and even having reached the five hundred mark, PTOV is a living project.
References
[1] http://periodicvideos.com/
[2] http://www.test-tube.org.uk
[3] http://www.sixtysymbols.com/
[4] http://www.numberphile.com/ [5] http://www.deepskyvideos.com/ [6] https://twitter.com/periodicvideos
[7] https://www.facebook.com/periodicvideos

Prof. Martyn Poliakoff, CBE
Is a Research Professor of Chemistry at Faculty of Science at the University of Nottingham and a pioneer in the field of green chemistry, working on gaining insights into fundamental chemistry and also on developing environmentally acceptable processes. He was elected a Fellow of the Academia Europaea and Associate Fellow of TWAS, the World Academy of Science. He is Foreign Secretary and Vice-President of the Royal Society and he was a Council Member of the IChemE (2009-2013). martyn.poliakoff@nottingham.ac.uk.

Dr. Samantha Tang
As Public Awareness Scientist, she occupies an unusual position in UK Science Communication. Her remit is to enthuse and excite schoolchildren and the public about science and to energise all members of the University’s School of Chemistry to participate in the communication of science. Her involvement in the PTOV project is focused on performing experiments that illustrate scientific principles. samantha.tang@nottingham.ac.uk.
[8] https://www.youtube.com/user/ periodicvideos
[9] http://periodicvideos.blogspot. com.es/
[10] HArAn, B.; PoliAkoFF, M. (2011). Nat. Chem., No. 3, p. 180.
[11] HArAn, B.; PoliAkoFF, M. (2011). Science, No. 332, p. 1046.

Brady Haran
Is an Australian independent filmmaker and video journalist who is known for his educational videos and documentary films produced for BBC News and for his YouTube channels. He’s passionate about science. In 2012 he was the producer, editor and interviewer behind 12 YouTube channels such as PTOV. Haran’s PTOV, with Professor Sir Martyn Poliakoff, received the Royal Society of Chemistry Nyholm Prize for Education in 2013. http://www.brady.haran.com.

Pep Anton Vieta
Received his Bachelor’s degree in chemistry and Master’s degree in medical chemistry and molecular design from the University of Girona, Spain (UdG). As a member of the Chair of Scientific Culture and Digital Communication at UdG, he is involved in the dissemination of science. He is completing his doctoral thesis at the Institute of Computational Chemistry and Catalysis at the UdG. josepantoni.vieta@udg.edu.
Monografia / Divulgació de la química 33
and the high
«The periodic table of videos»: an excellent bridge between
university research
school chemistry classroom
«UAu, això és química!»
«UAu, this is chemistry!»
Josep Duran / Universitat de Girona
Pep Anton Vieta / Universitat de Girona
Tania López / Universitat de Girona
Terenci Corominas / Escola Universitària ERAM
resum

«UAu, això és química!» és una eina al servei dels professors de química de batxillerat. Consisteix en vídeos de curta durada que tracten setze temes de química. Aquests temes es corresponen amb el temari de batxillerat, dels estats de la matèria a les reaccions químiques, de l’estructura atòmica a la química orgànica. L’estructura dels vídeos és la mateixa: es parteix d’una situació quotidiana, propera als alumnes, de la qual sorgeix una pregunta. Els científics responen amb una curta explicació acompanyada d’un experiment químic espectacular. Així, aquests vídeos poden esdevenir una bona forma d’introduir un tema a l’aula.
paraules clau
Química, batxillerat, experiment, química recreativa, química espectacular, motivació.
abstract
«UAu, this is chemistry!» is a tool for high school chemistry teachers. It consists of short videos that deal with sixteen chemistry issues. These topics relate to the Chemistry curriculum at high school: from the states of matter in chemical reactions to atomic structure in organic chemistry. The structure of the videos is the same: they start with an everyday situation, relevant to the students, in which a question arises. Scientists respond with a short explanation accompanied by a spectacular chemical experiment. These videos can therefore become a good way to introduce a topic in the classroom.
keywords
Chemistry, college, experiment, recreational chemistry, spectacular chemistry, motivation.
Introducció
Des de fa gairebé deu anys, el nostre grup s’ha desplaçat a nombrosos centres preuniversitaris per sembrar entre els estudiants la llavor de les vocacions científiques. Per fer-ho, hem utilitzat experiments de química recreativa. Els experiments atrauen l’atenció dels estudiants, els quals es mostren més interessats a conèixer els processos que hi tenen lloc (Lister, 2002; Shakhashiri, 1983). La nostra presència és sempre ben rebuda en els centres de secundària i batxillerat, tant per part d’alumnes com de professors, que sovint es troben amb la
dificultat de poder oferir als alumnes l’oportunitat de realitzar experiments de química al laboratori.
El projecte que es presenta pretén oferir als centres la possibilitat de consultar i utilitzar a l’aula experiments realment impactants de química a través de la xarxa. Per a això, en col·laboració amb centres de batxillerat, s’ha dividit el temari de química en setze temes, els quals es presenten mitjançant un experiment visualment atractiu. L’experiment s’inicia amb una introducció consistent en una situació quotidiana i familiar per als alumnes, com
l’esport, la moda, l’amistat, etc., per atraure la seva atenció. Seguidament, un experiment espectacular centrarà el tema que a continuació el professor vol exposar a classe. Tots els experiments es poden consultar a través dels canals de vídeo més populars presents a la xarxa.
Desenvolupament del projecte
La divisió del temari s’ha fet en funció del currículum de batxillerat. Els primers temes són comuns amb el temari de l’ensenyament secundari obligatori, per la qual cosa els vídeos també poden ser usats en aquest
ISSN 2013-1755, SCQ-IEC Educació Química EduQ número 18 (2014), p. 34-43 DOI: 10.2436/20.2003.02.133 http://scq.iec.cat/scq/index.html 34
nivell. La divisió és com segueix a continuació:
— Experiment 1. Mescles homogènies (fòsfor vermell i clorat potàssic amb efecte papallona).
— Experiment 2. Mescles heterogènies (oli, aigua i sodi).
— Experiment 3. Estat sòlid (arbre cristal·litzat).
— Experiment 4. Estat líquid (difusió del líquid).
— Experiment 5. Estat gasós (nitrogen líquid).
— Experiment 6. Reaccions químiques (reaccions en cadena).
— Experiment 7. Cinètica de reacció (persulfat i iodur).
— Experiment 8. Equilibri químic (equilibri entre el diòxid de nitrogen i el tetraòxid de dinitrogen).
— Experiment 9. Equilibri de solubilitat i complexació (estalagmita d’acetat sòdic).
— Experiment 10. Equilibri de transferència de protons (arc de Sant Martí amb indicadors).
— Experiment 11. Reaccions de transferència d’electrons (I) (Belousov-Zhabotinsky).
— Experiment 12. Reaccions de transferència d’electrons (II) (volcà de dicromat d’amoni).
— Experiment 13. Termodinàmica. Reacció endotèrmica (hidròxid de bari i tiocianat d’amoni).
— Experiment 14. Termodinàmica. Reacció exotèrmica (oxidació de l’alumini amb brom).
— Experiment 15. Teoria atòmica (flames de colors).
— Experiment 16. Sistema periòdic (clorat, bromat i iodat potàssic amb sofre i àcid sulfúric).
— Experiment 17. Enllaç químic (termita).
— Experiment 18. Química orgànica (obtenció d’un poliuretà).
Els vídeos consten de dues parts. La primera part consisteix en una situació quotidiana de la qual sorgeix una pregunta. Per exemple, un jove grup de música pregunta si la música i la taula
periòdica tenen alguna relació. En una sala, una parella de ball pregunta si els àtoms també s’ajunten per «ballar» junts. Davant un monument, un fotògraf pregunta si la degradació de les roques calcàries té a veure amb la química. Dins una cova, un espeleòleg pregunta com es formen les estalagmites (fig. 1).
experiments, els lectors podran valorar la idoneïtat (o no) de realitzar-los en viu.
Experiment 1. Mescles homogènies
Es barreja una porció de fòsfor vermell amb una porció de clorat de potassi. És suficient una punta d’espàtula petita. Seguidament, amb una ploma i amb molta cura,

La segona part del vídeo consisteix a donar resposta a la pregunta amb una explicació científica simple, concreta i comprensible però rigorosa. Aquesta resposta serveix d’introducció al tema que es tractarà a l’aula. La resposta s’acompanya amb un experiment espectacular.
Els experiments
Aquests experiments s’han decidit filmar perquè presenten alguna complicació a l’hora de realitzar-los en viu, sigui en una aula o en un laboratori docent. Alguns experiments s’han filmat en un laboratori fictici, mentre que d’altres s’han gravat en una antiga fàbrica tèxtil. Poden ser reaccions perilloses, llargues o difícils. En les descripcions dels
es barregen les dues substàncies fins a aconseguir una mescla homogènia. La reacció s’inicia per fricció, per la qual cosa cal fer aquest experiment amb molta delicadesa i amb poca quantitat de reactius.
Un cop barrejades les substàncies, amb l’ajuda d’un martell, s’activa la reacció donant un cop sobre la barreja: s’aconsegueix una gran explosió, de la qual es desprèn un gas homogeni (Shakhashiri, 1983). Només podem apreciar una mena de fum, que correspon al pentòxid de fòsfor i al clorur de potassi.
3 P4 + 10 KClO3 → 3 P4O10 + 10 KCl
Es pot fer a molt petita escala en una aula o en un laboratori ben ventilat.
Monografia / Recursos didàctics 35 «UAu, això és química!»
Figura 1. Imatge de la cova de l’Orri, on es va gravar la introducció del tema de l’equilibri de solubilitat.
Experiment 2. Mescles heterogènies
Dins un recipient, s’aboca una gran quantitat d’aigua i unes gotetes de l’indicador àcid–base fenolftaleïna. A continuació, a sobre d’aquesta capa aquosa, s’afegeix una quantitat una mica més petita d’oli. Es talla un petit tall de sodi metall, aproximadament de la mida d’un cigró, i s’introdueix amb molta cura en el recipient per poder començar a veure la reacció. El sodi travessarà la capa d’oli sense reaccionar-hi, però, quan entri en contacte amb l’aigua, reaccionarà per desprendre hidrogen i es formarà hidròxid sòdic. Aquesta base farà virar l’indicador a un color rosat.
Si la reacció es fes amb unes altres condicions, seria molt perillosa, ja que la reacció del sodi amb l’aigua és molt violenta: es produeix una reacció molt exotèrmica.
Na + H2O → NaOH (aq) + H2
Es pot fer a petita escala a l’aula o al laboratori.
Experiment 3. Estat sòlid
Es fa cristal·litzar una dissolució concentrada d’hidrogenfosfat d’amoni. En el cas presentat, la dissolució es fa pujar per capil·laritat per un cartró porós que pren la forma d’un arbre. Als extrems, que és on hi ha més evaporació, comencen a formar-se cristalls del sòlid. Una mica de colorant alimentari a les branques de l’arbre dóna un bonic color rosat als agregats cristal·lins. Per a aquest experiment no calen mesures de seguretat extraordinàries, però és un experiment lent i pot trigar unes vuit hores o més a completar-se.
Experiment 4. Estat líquid
Es preparen dos recipients, l’un amb aigua freda i l’altre amb aigua calenta. Es deixen caure unes gotes de colorant alimentari
Es fa cristal·litzar una dissolució concentrada d’hidrogenfosfat d’amoni. En el cas presentat, la dissolució es fa pujar per capil·laritat per un cartró porós que pren la forma d’un arbre
en cadascun dels recipients i es comprova que el colorant es difon molt millor en l’aigua calenta. L’experiment es complementa amb la difusió d’una petita quantitat de fluoresceïna sota llum ultraviolada a les fosques. La primera part de l’experiment no necessita una gran instrumentació ni reactius difícils de trobar i, per tant, es pot fer a l’aula. És més complicat disposar de fluoresceïna i de llum ultraviolada.
Experiment 5. Estat gasós
L’experiment que es presenta consisteix a abocar nitrogen líquid en una piscina i a observar-ne la ràpida evaporació. Tot i que el nitrogen gasós no es veu, el seu traç es torna visible gràcies a la condensació i la solidificació de petites gotes d’aigua de la humitat de l’aire. Així, el traç del nitrogen fred és un núvol. Per a un centre de secundària, és difícil
aconseguir i emmagatzemar nitrogen líquid. En aquest experiment, s’ha volgut buscar l’espectacularitat d’abocar una gran quantitat de nitrogen líquid en un gran volum d’aigua.
Experiment 6. Reaccions químiques
Per presentar diferents tipus de reaccions químiques, es fa una gran reacció en cadena. Es parteix de la reacció entre bicarbonat i vinagre, que genera CO2, el qual es fa servir com a reactiu i com a impulsor de la resta de les reaccions.
NaHCO3 + CH3COOH → CH3COONa (aq) + CO2 + H2O
A la primera reacció, el CO2 es fa reaccionar amb una dissolució de fenolftaleïna en medi lleugerament bàsic. Com a resultat, l’indicador es torna incolor, la qual cosa correspon a la fenolftaleïna en medi àcid.
Aquesta és una reacció de transferència de protons (àcid–base).
A la segona reacció, el CO2 es fa passar per una dissolució d’hidròxid de calci, amb la qual cosa es forma carbonat de calci, insoluble. El resultat és la formació d’un precipitat de carbonat de calci:
Ca(OH)2 + CO2 → CaCO3 + H2O

36 Educació Química EduQ número 18
Figura 2. Experiment de l’estat gasós en què es comprova com el nitrogen líquid es converteix en gas en qüestió de segons.
Es tracta d’una reacció de precipitació.
El CO2 impulsa NaOH sobre una dissolució aquosa d’extracte de col vermella, que conté un indicador de pH natural anomenat cianidina. A pH neutre, el color és lila, mentre que a pH bàsic, el color és verd i pot arribar fins al groc:
NaOH + C15H11O6 → C15H10O6 (aq) + Na+ (aq) + H2O (cianidina → anió cianidina)
Aquesta tercera reacció és una reacció de transferència de protons (àcid–base).
A la quarta reacció, el CO2 impulsa una dissolució de H2O2 sobre una dissolució de KI amb unes gotes de midó. El peròxid d’hidrogen oxida el iodur a iode, i el iode forma un complex de color lila molt intens amb el midó, per la qual cosa s’observa com la dissolució incolora de iodur es torna fosca:
H2O2 + 3 KI →
I3 (aq) + 3 K+ (aq) + 2 OH (aq)
El midó és un polisacàrid i el complex es dóna quan aquesta estructura polimèrica embolcalla els ions I3
Aquesta reacció és de transferència d’electrons (d’oxidacióreducció, redox).
A la darrera reacció, s’impulsa àcid ascòrbic, que prové d’una pastilla comercial de vitamina C, sobre una dissolució que conté iode i midó. El color d’aquesta dissolució és fosc pel complex entre iode i midó que acabem de comentar. Quan reacciona amb l’àcid ascòrbic, el iode es redueix a iodur, per la qual cosa el complex es trenca i la dissolució es torna incolora.
I3 (aq) + C6H8O6 (aq) → C6H6O6 (aq) + 3 I (aq) + 2 H+ (aq)
Els reactius són fàcils de trobar i les reaccions no són perilloses, però el muntatge pot ser una mica complicat de realitzar a l’aula en una hora.
Experiment 7. Cinètica de reacció
Hi ha diverses reaccions de les quals es pot observar l’evolució al llarg del temps. Com a exemple d’aquest tema de batxillerat, s’ha escollit la reacció entre una dissolució de iodur de potassi i peroxodisulfat de potassi en presència de midó. La reacció té lloc a una velocitat que depèn de la concentració dels reactius i, quan es completa, s’observa per la formació del complex entre iode i midó:
S2O82− (aq) + 3 I (aq) → I3 (aq) + SO42− (aq)
Altres reaccions que es fan visibles, com aquesta, també tenen com a protagonista la formació del complex entre iode i midó. Per exemple, la reacció entre iodur i iodat o entre iodat i hidrogensulfit sòdic (Shakhashiri, 1992). Qualsevol de les reaccions comentades es pot fer a l’aula o al laboratori, però, si es volen fer diferents concentracions, com en aquest cas, es necessitarà una bona estona de preparació. Alternativament, és possible calcular l’ordre de la reacció i la constant de velocitat, però això s’escapa dels objectius del present projecte.
Experiment 8. Equilibri químic
Un dels exemples clàssics de reaccions en equilibri són les reaccions reversibles, més concretament, l’equilibri de dimerització del diòxid de nitrogen:
2 NO2 (g) D N2O4 (g)
Taronja vermellós incolor
El NO2 és un gas irritant de color taronja vermellós que se
sintetitza fàcilment mitjançat la reacció entre coure metàl·lic i àcid nítric diluït:
Cu + 4 HNO3 (aq) → 2 NO2 (g) + Cu2+ (aq) + 2 NO3 (aq) + 2 H2O
Per evitar respirar el NO2, si no es disposa d’una campana de gasos, es pot sintetitzar dins d’un recipient que es pugui tancar i pressionar, com una xeringa. D’aquesta forma, es pot estudiar l’equilibri entre el diòxid de nitrogen i el seu dímer.
Quan es pressiona el NO2 amb l’èmbol, primer s’observa com el color s’enfosqueix a causa de la concentració de gas en un espai menor, però de seguida la reacció es desplaça cap a la formació del dímer pel principi de Le Châtelier. Després de pocs segons, el color desapareix gairebé totalment.
Quan es torna a desplaçar l’èmbol i s’expandeix el gas, no hi ha un canvi de color immediat, ja que es veu gairebé incolor. Pel mateix principi, però, es forma el monòmer i ràpidament es torna a observar el color vermellós del NO2 L’equilibri es pot observar en diverses ocasions, sobretot si el sistema és prou estanc.
Aquesta reacció es pot fer a l’aula a petita escala amb una xeringa, però no es visualitza gaire bé.
Quan es pressiona el NO2 amb l’èmbol, primer s’observa com el color s’enfosqueix a causa de la concentració de gas en un espai menor, però de seguida la reacció es desplaça cap a la formació del dímer pel principi de Le Châtelier. Després de pocs segons, el color desapareix gairebé totalment
Monografia / Recursos didàctics 37 «UAu, això és química!»

Experiment 9. Equilibri de solubilitat i complexació
Per fer aquest experiment, s’ha de preparar una dissolució supersaturada d’acetat sòdic en aigua (Hiegel, 1980). Les proporcions són 50 g d’acetat sòdic trihidratat en 5 ml d’aigua. La dissolució es fa en calent i es deixa refredar fins a temperatura ambient. En la dissolució, també s’utilitzen les aigües d’hidratació. La dissolució és metaestable i qualsevol pertorbació la fa precipitar: una agitació sobtada, una irregularitat en el recipient, etc.
La dissolució es vessa lentament sobre una superfície a la qual s’han afegit uns cristalls d’acetat sòdic sòlid, que actuen de nuclis de cristal·lització.
A mesura que la dissolució cau, va cristal·litzant. La reacció de cristal·lització, a més, és exotèrmica.
L’experiment també es pot fer a l’aula, però té l’inconvenient de la sensibilitat de la dissolució metaestable, ja que pot precipitar en qualsevol moment.
Experiment 10. Equilibri de transferència de protons
Hi ha moltes reaccions de tipus àcid–base, però, en aquest cas, n’hem escollit una de visualment atractiva. Concretament, l’arc de Sant Martí amb indica-
dors. Cal preparar una dissolució diluïda de NaOH (0,05 M és suficient) i dissolucions de tres indicadors: fenolftaleïna, timolftaleïna i p-nitrofenol. Per aconseguir els diferents colors, es disposen els indicadors en set vasos de precipitats de la forma següent:
— Vermell: 10 gotes de fenolftaleïna + 4 gotes de nitrofenol + 2 gotes de H2SO4 2,5 M.
— Taronja: 2 gotes de fenolftaleïna + 14 gotes de nitrofenol + 2 gotes de H2SO4 2,5 M.
— Groc: 15 gotes de nitrofenol + 2 gotes de H2SO4 2,5 M.
— Verd: 6 gotes de timolftaleïna + 10 gotes de nitrofenol + 2 gotes de H2SO4 2,5 M.
— Blau: 15 gotes de timolftaleïna.
— Lila: 7 gotes de fenolftaleïna + 7 gotes de timolftaleïna.
— Violat: 15 gotes de fenolftaleïna.
Hi ha moltes varietats d’aquest mateix experiment, però, en aquest cas, es va procedir simplement abocant la dissolució bàsica sobre les dissolucions d’indicadors. Els indicadors són quasi invisibles i, per reacció amb la solució bàsica, s’observa la formació dels colors corresponents a l’arc de Sant Martí (Aguilar Muñoz, Fernández Tapia i Durán Torres, 2011).
La reacció no presenta problemes per ser realitzada a l’aula. L’efecte és molt atractiu i permet parlar de l’escala i dels indicadors de pH.
Experiment 11. Reaccions de transferència d’electrons (I)
Com en el cas anterior, hi ha moltes reaccions en què intervenen oxidacions i reduccions d’espècies químiques. La reacció escollida, que és la de Belousov-Zhabotinsky, es podria considerar també una reacció de cinètica química. Per fer aquesta reacció, cal un recipient i un agitador magnètic i, a més, cal preparar quatre dissolucions de la forma següent:
— Solució A: es dissolen 0,22 g de Ce (SO4)2 • 4 H2O en 75 ml d’aigua destil·lada i, a continuació, s’hi afegeixen lentament 25 ml d’àcid sulfúric concentrat i es va agitant. Finalment, s’afegeix H2O2 del 3 % gota a gota fins que el color groc del ceri hagi desaparegut.
— Solució B: es dissolen 3,12 g de bromat de potassi en 100 ml d’aigua destil·lada.
— Solució C: es prepara una solució de ferroïna 0,01 M de la forma següent: es dissolen 0,55 g de sulfat de ferro (II) heptahidratat en 200 ml d’aigua destil·lada i,
Hi ha moltes reaccions de tipus àcid–base, però, en aquest cas, n’hem escollit una de visualment atractiva. Concretament, l’arc de Sant Martí amb indicadors. Cal preparar una dissolució diluïda de NaOH (0,05 M és suficient) i dissolucions de tres indicadors: fenolftaleïna, timolftaleïna i p-nitrofenol
38 Educació Química EduQ número 18
Figura 3. Una columna de cromatografia i un èmbol casolà permeten visualitzar força bé l’equilibri entre el diòxid de nitrogen i el seu dímer.
a continuació, s’afegeixen 1,18 g de 1,10-fenantrolina. Finalment, cal filtrar la dissolució.
— Solució D: es dissolen 8,58 g d’àcid malònic en 100 ml d’aigua destil·lada.
Un cop preparades les quatre dissolucions, es disposen uns 10 ml de cada una, per ordre, en el recipient que té agitació. Només de la dissolució C s’hi afegeixen deu gotes (Jahnke i Winfree, 1991).
Quan es prepara la solució A i s’afegeix el H2SO4, la solució es torna de color groc i desprèn calor, ja que és molt exotèrmica. Si és possible, és convenient afegir l’àcid lentament i sota una campana extractora de gasos. El fet que la solució sigui groga és pel sulfat de ceri, però, a mesura que s’aboca la dissolució de H2O2, aquesta es torna incolora en pocs segons.
En aquesta reacció, es barregen tres solucions incolores per donar lloc a oscil·lacions periòdiques entre els colors vermell i blau, passant pel groc, el verd i el lila.
La reacció és una mica complicada de fer, perquè calen reactius poc habituals en un laboratori de secundària. Més aviat es podria considerar una pràctica, si diferents grups preparen les diferents dissolucions. L’experiment permet mesurar la cinètica d’algunes reaccions que hi tenen lloc.
Experiment 12. Reaccions de transferència d’electrons (II)
Un dels motius de la filmació de vídeos per al projecte «UAu, això és química!» era filmar experiments poc recomanables de fer a l’aula. Aquest i la reacció entre el brom i l’alumini en són dos clars exemples. Per a aquesta segona reacció de tipus redox, s’ha escollit l’experiment conegut com a volcà de dicromat, en el qual es fa servir dicromat d’amoni i es desprèn triòxid de crom. Ambdues
substàncies són tòxiques i també perilloses per al medi ambient. Això contrasta amb la «lleugeresa» amb què es presenta l’experiment a la xarxa.
L’experiment és senzill de fer: només cal encendre un piló de dicromat d’amoni perquè es produeixi la reacció (Shakhashiri, 1983). El reactiu conté l’oxidant (el dicromat) i el reductor (l’amoni):
(NH4)2Cr2O7 → Cr2O3 (s) + 4 H2O (g) + N2 (g)
És un experiment gens recomanable de fer, fins i tot si es fa sota una vitrina.
Experiment 13. Termodinàmica. Reacció endotèrmica
Per presentar el tema de la termodinàmica química, ens va semblar una bona idea diferenciar reaccions endotèrmiques i exotèrmiques. Les primeres són menys habituals i una bona part de les reaccions descrites en aquest article ho són.
La reacció endotèrmica escollida ha estat un clàssic: es tracta de la reacció entre l’hidròxid de bari i el tiocianat d’amoni, que pot representar-se de forma senzilla com segueix:
Ba(OH)2 (s) + 2 NH4SCN (s) → Ba(SCN)2 (s) + 2 NH3 (g) + 2H2O (l)

Monografia / Recursos didàctics 39 «UAu, això és química!»
Figura 4. L’espectacular experiment amb brom i alumini genera una gran quantitat de vapors de tribromur d’alumini en una reacció altament exotèrmica.
Es disposen 30 g d’hidròxid de bari en un vas de precipitats i s’hi afegeixen 13 g de tiocianat d’amoni. Els dos sòlids es barregen amb un vareta de vidre i s’espera una estona per comprovar com la temperatura de la mescla disminueix fins a baixar per sota dels 0 ºC. Alternativament, es pot fer servir també el clorur d’amoni, però amb el tiocianat s’aconsegueixen temperatures més baixes (Lister, 2002). La reacció és senzilla i es pot fer al laboratori, si se segueixen les normes de seguretat habituals.
Experiment 14. Termodinàmica. Reacció exotèrmica
La reacció entre el brom i l’alumini desprèn una gran quantitat d’energia. Tant el brom com el tribromur d’alumini que es forma són tòxics i, per aquest motiu, no és gens recomanable fer aquesta reacció al laboratori (i encara menys a l’aula). Per fer la reacció, s’introdueixen uns mil·lilitres de brom dins un tub d’assaig i s’hi afegeix un tros de paper d’alumini. Després d’uns segons, s’inicia una reacció exotèrmica que encén part dels vapors que es formen:
3 Br2 (l) + 2 Al (s) → 2 AlBr3 (g)
Experiment 15. Teoria atòmica
Els alquimistes ja s’havien adonat que diferents elements (o substàncies) cremaven amb flames de colors diferents. Fins que Bunsen i Kirchoff no van inventar el primer espectroscopi, no es van poder diferenciar i identificar aquests colors de les flames. L’invent va ser cabdal en l’elaboració de la primera teoria atòmica basada en la quantització de l’energia. La teoria podia explicar bé els senyals observats en l’espectre d’emissió de l’hidrogen.
Les flames de colors són el fil conductor d’aquestes senzilles explicacions i s’obtenen també de
forma senzilla. Sobre una superfície resistent a la calor, es disposa una petita capa de sorra. La sorra es mulla amb etanol i aquest s’encén. Sobre la flama, en diferents llocs de la safata, es disposen sals de diversos metalls, que cremen amb un color característic a la flama. Per exemple, el clorur de liti crema de color vermell; el clorur de sodi, de color groc; l’àcid bòric, de color verd, i el clorur de coure (II), d’un color verd blavós (Duran i Vieta, 2011).
Els alquimistes ja s’havien adonat que diferents elements (o substàncies) cremaven amb flames de colors diferents. Fins que Bunsen i Kirchoff no van inventar el primer espectroscopi, no es van poder diferenciar i identificar aquests colors de les flames
L’experiment no és perillós i es pot fer a l’aula. És interessant enfosquir l’aula o el laboratori per observar millor els colors. Alternativament, es pot construir un espectroscopi casolà i comprovar-ne el funcionament mirant les flames dels elements.
Experiment 16. Sistema periòdic Els halògens són un dels grups amb un comportament més regular. En aquest experiment es compara la reactivitat dels halogenats amb sofre en medi àcid. La reacció general, representada en aquest exemple pel iodat, és la següent:
S + 2 KIO3 + H2SO4 → I2 (g) + SO2 (g) + H2O + 2 K+ (aq) + SO42− (aq)
Es barregen 1 g de sofre i 0,1 g de l’halogenat. La barreja s’ha de
fer amb precaució, ja que, en el cas del bromat, la reacció esperada es podria iniciar només amb el fregament. Un cop barrejat, es disposa en una càpsula de porcellana i s’hi afegeixen una o dues gotes d’àcid sulfúric concentrat. La reacció comença en pocs segons.
En el cas del iodat, s’observa la formació d’un gas de color violat, que correspon al iode gasós. La reacció és molt més violenta amb el bromat que amb el iodat, ja que, en aquest cas, s’observa una deflagració intensa. Per al cas del clorat, aquest s’arriba a reduir a clorur.
L’experiment, que despèn iode (o brom!) i en el qual es manipula àcid sulfúric concentrat, no s’ha de fer a l’aula. Al laboratori, cal fer-lo sota la vitrina.
Experiment 17. Enllaç químic
En totes les reaccions comentades, es trenquen i es formen enllaços, però aquests canvis no són evidents. Molt sovint, quan expliquem exemples de reaccions químiques quotidianes i senzilles als alumnes més joves, els posem l’exemple del ferro que es rovella. En la reacció proposada, té lloc la reacció inversa: el rovell es torna ferro.
Aquesta reacció és l’anomenada reacció termita, que té lloc entre òxid de ferro i alumini per donar lloc a ferro i òxid d’alumini:
FeO3 (s) + Al (s) → AlO3 (l) + Fe (l)
No és cap errada tipogràfica que el ferro obtingut sigui líquid. De fet, que el ferro sigui líquid (fos) és el que fa tan atractiva la reacció, que s’ha utilitzat com a demostració espectacular des de fa anys (Fine, 1931).
Per fer la reacció, cal una proporció 3:1 d’òxid de ferro i alumini. Per a una petita demostració, són suficients 3 g d’òxid de ferro i, d’aquesta forma, es pot fer al la-
40 Educació Química EduQ número 18
boratori. Per iniciar la reacció, es pot fer servir una tira de magnesi, però nosaltres fem servir una bengala infantil, molt més fàcil de trobar i igualment eficaç.

Experiment 18. Química orgànica
Com a experiment demostratiu de química orgànica, s’ha escollit la formació d’una escuma de poliuretà. Els poliuretans s’obtenen per reacció entre un poliol i un isocianat, i es poden representar de forma genèrica per la reacció següent:
que es fan servir d’aïllants en la construcció. En el nostre cas, la relació entre uretà i poliol ha estat de 60/100 i s’ha obtingut una escuma de poliuretà rígida, d’una consistència semblant a la d’un seient de cotxe.
No ha estat fàcil trobar els reactius en els distribuïdors habituals, de manera que hem hagut de recórrer a indústries locals de fabricació de poliuretans, que amablement ens han cedit els reactius.
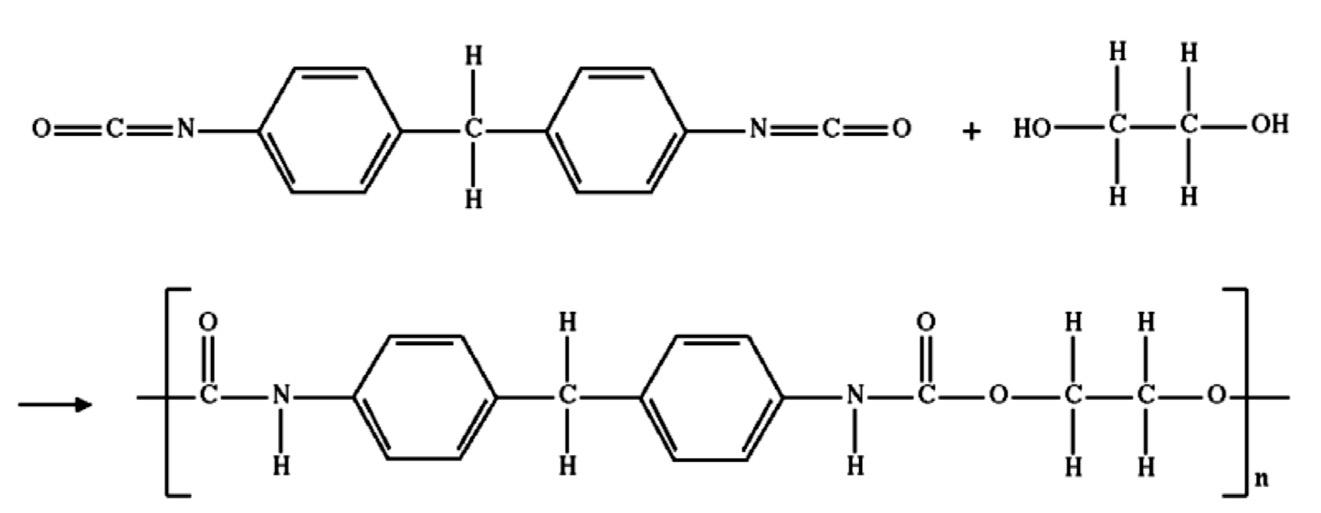
Segons el tipus d’uretà, el de poliol i la relació entre ells, s’obtenen diferents tipus d’escumes de poliuretà, des de més toves, com les que omplen els coixins, fins a més dures, com les
Avaluació dels resultats
El projecte es va presentar en públic el dia 28 de gener. El balanç dels tres primers mesos, fins al 28 d’abril, és altament positiu. Els vídeos han tingut set mil nou-
centes seixanta-una visualitzacions i vuitanta-sis subscripcions. El nombre de visualitzacions ha estat variable, sobretot al principi, i ha presentat dues puntes impor-
Segons el tipus d’uretà, el de poliol i la relació entre ells, s’obtenen diferents tipus d’escumes de poliuretà, des de més toves, com les que omplen els coixins, fins a més dures, com les que es fan servir d’aïllants en la construcció. En el nostre cas, la relació entre uretà i poliol ha estat de 60/100 i s’ha obtingut una escuma de poliuretà rígida, d’una consistència semblant a la d’un seient de cotxe
tants: el dia 28 de gener, en què es va presentar el projecte a la comunitat educativa i a la premsa, i el dia 9 de febrer, en què el programa Espai Internet, de Televisió de Catalunya, va fer referència al web i al canal de YouTube.
Altres increments destacats en el nombre de visualitzacions corresponen a la nostra participació en el programa Espai Terra, també de Televisió de Catalunya, en què es va fer esment del projecte «UAu, això és química!».
Després d’aquest inici, hem volgut fer un estudi serè de l’evolució del darrer mes (abril), en el qual hem observat una regularitat en el nombre de visites, que es calculen al voltant de trenta-cinc. Cal tenir en compte que el mes d’abril, a efectes lectius, és molt curt, ja que inclou la setmana santa.
Una dada interessant correspon a les persones que visiten el canal, majoritàriament homes
Monografia / Recursos didàctics 41 «UAu, això és química!»
Figura 5. La reacció termita és una espectacular reacció en què s’obté ferro fos i que permet foradar planxes metàl·liques com la d’aquesta rentadora.
d’entre quaranta-cinc i cinquanta-cinc anys. Aquesta dada ens fa suposar que una bona part de les visualitzacions es deu fer a l’aula, per la qual cosa el nombre de persones (alumnes) que veuen els vídeos és molt més gran. És interessant veure que la franja d’edat compresa entre els tretze i els disset anys també hi mostra interès, ja que és la tercera franja més activa.
jecte «Reacciona... explota!» (http://www.reacciona.cat) o del portal de Recerca en Acció, a l’apartat «Experimenta» (http://www.recercaenaccio.cat/ experimenta/uau-18-experimentsde-quimica/).
Així mateix, l’Escola Universitària ERAM, a través del seu canal de televisió, té publicats els vídeos a través del portal Vimeo (http:// eramtv.cat/).
ticipat amb tot el personal tècnic, càmeres, so, producció i edició, i també ha cedit espais, com el plató i l’espai obert on s’han realitzat les filmacions dels experiments.
La Fundació Catalana per a la Recerca, en el seu portal Recerca en Acció, ha col·laborat en la difusió dels vídeos del programa Kopernik en l’apartat «Experimenta» del web.
7. Gràfic de les franges d’edat i sexe que més han visualitzat el canal. Dades procedents de YouTube Analytics.
Els webs i els canals de vídeos
Els vídeos estan disponibles, des de la seva presentació, a la llista de reproducció «UAu!» del canal Reaccionaexplota de YouTube (http://tinyurl.com/uauaixoesquimica). Es pot accedir a la llista a través del web del pro-
Participants en el projecte
Aquest és un projecte de la càtedra de Cultura Científica i Comunicació Digital de la Universitat de Girona en col·laboració amb l’Escola Universitària ERAM, adscrita a la mateixa Universitat. L’escola hi ha par-
Altres entitats i empreses han cedit espais o materials per fer experiments. També particulars, persones individuals, de forma desinteressada, ens han permès filmar a casa seva algunes introduccions i, fins i tot, experiments.
42 Educació Química EduQ número 18
Figura 6. Gràfic del nombre de visites al canal els tres mesos posteriors a la presentació del projecte. Dades procedents de YouTube Analytics.
Figura
El projecte ha estat finançat per la Fundación Española para la Ciencia y la Tecnología (FECyT) i pel Ministeri d’Economia i Competitivitat.
Conclusions
El projecte presenta un total de divuit vídeos, que corresponen a la divisió del temari de batxillerat en setze temes, des dels estats de la matèria fins a l’estructura atòmica. La finalitat és que esdevinguin una eina per al professorat de batxillerat i que siguin útils per presentar cadascun dels temes. Els vídeos es troben disponibles a la xarxa, en les plataformes YouTube i Vimeo i són accessibles a través dels portals de Recerca en Acció, del projecte «Reacciona... explota!» i de l’ERAM. Segons les dades de seguiment de les diverses plataformes, els vídeos han estat visualitzats en vuit mil ocasions, la qual cosa suposa un gran èxit. Tenint en compte les mateixes fonts d’informació, la franja d’edat que més visualitza els vídeos és la compresa entre els quaranta-cinc i els cinquantacinc anys, per la qual cosa es pot suposar que es tracta de professors que mostren aquests vídeos a l’aula.
Referències
AguilAr muñoz, M.; Fernández tAPiA, M.; durán torres, C. (2011). «Experiencias curiosas para enseñar química en el aula». Educació Química EduQ, núm. 8, p. 23-34.
durAn, J.; vietA, P. A. (2011). «“Reacciona... explota!”, un taller per fomentar les vocacions científiques». Educació Química EduQ, núm. 10, p. 34-40.
Fine, I. (1931). «Some spectacular experiments in chemistry». J. Chem. Educ., vol. 8, núm. 5, p. 929-935.
Hiegel, G. A. (1980). «Crystallization of sodium acetate». J. Chem. Educ., vol. 57, núm. 2, p. 152.
jAHnke, W.; winFree, A. T. (1991). «Recipes for Belousov-Zhabotinsky reagents». J. Chem. Educ., vol. 68, núm. 4, p. 320-324. lister, T. (2002). Experimentos de química clásica. Madrid: Síntesis, p. 167-170.
sHAkHAsHiri, B. Z. (1983). Chemical demonstrations: A handbook for

Josep Duran
És professor titular de química a la Universitat de Girona i doctor en química per la mateixa Universitat. Ha treballat en diferents projectes de millora de la qualitat docent universitària i, des de l’any 2003, treballa en l’establiment de ponts amb secundària. La seva recerca se centra en el camp dels catalitzadors i en la comunicació científica. És responsable de diverses accions per al foment de les vocacions científiques dirigides a estudiants preuniversitaris.
A/e: josep.duran@udg.edu

Pep Anton Vieta
És llicenciat en química per la Universitat de Girona (UdG) i màster en química mèdica i disseny molecular per la mateixa Universitat. Com a membre de la càtedra de Cultura Científica i Comunicació Digital de la UdG, realitza tasques de divulgació i comunicació de la ciència. Actualment també està desenvolupant una tesi doctoral a l’Institut de Química Computacional i Catàlisi de la UdG.
A/e: josepantoni.vieta@udg.edu
teachers of chemistry. Vol. 1. Madison: University of Wisconsin Press, p. 81-82. (1992). Chemical demonstrations: A handbook for teachers of chemistry. Vol. 4. Madison: University of Wisconsin Press, p. 16-18.

Tania López
És llicenciada en química per la Universitat de Girona. Durant el darrer curs de la llicenciatura, ha col·laborat amb la càtedra de Cultura Científica i Comunicació Digital, on ha realitzat el treball de recerca.
Ha fet divulgació de la química en diferents àmbits, com ara en presentacions a centres preuniversitaris o en el projecte «UAu, això és química!».
A/e: tanialm67@gmail.com.

Terenci Corominas
És llicenciat en Contemporary Lens Media per la Universitat de Lincoln i graduat en realització audiovisual i multimèdia per l’Escola Universitària ERAM. Ha dirigit nombrosos projectes audiovisuals en totes les disciplines: videoclips, espots, curtmetratges, videoart i documentals. Actualment, combina les tasques de direcció amb la docència a la universitat, on és professor de Realització audiovisual i Direcció audiovisual en el grau d’audiovisual i multimèdia.
A/e: suport04@eram.cat
Monografia / Recursos didàctics 43 «UAu, això és química!»
Petardos, cohetes y mucha química
Petards, coets i molta química
Firecrackers, rockets and a lot of chemistry
Fernando Ignacio de Prada Pérez de Azpeitia / IES Las Lagunas. Rivas (Madrid)
resumen

Los espectaculares efectos que producen petardos y cohetes están relacionados con la ciencia, por lo que pueden ser aprovechados como un inusual y atractivo recurso didáctico para la química. Con esto se pretende conseguir aumentar el interés de los estudiantes hacia la ciencia, a la vez que ampliar el conocimiento sobre las reacciones químicas relacionadas con su vida cotidiana. Las experiencias propuestas han sido realizadas por estudiantes ante un público muy variado en ferias de ciencia divulgativas.
palabras clave
Petardos y química, cohetes y química, pirotecnia química.
resum
Els espectaculars efectes que produeixen els petards i coets estan relacionats amb la ciència, per la qual cosa poden ser aprofitats com un inusual i atractiu recurs didàctic per a la química. Amb això es pretén aconseguir augmentar l’interès dels estudiants cap a la ciència, alhora que ampliar el coneixement sobre les reaccions químiques relacionades amb la vida quotidiana. Les experiències proposades han estat realitzades per estudiants davant un públic molt variat en fires de ciència divulgatives.
paraules clau
Petards i química, coets i química, pirotècnia química.
abstract
The spectacular effects produced by firecrackers and rockets are based on the science. They can therefore be used as an unusual and attractive didactic resource for chemistry learning. What we intend is to extend scientific knowledge and to increase the interest of students towards chemical reactions related to daily life situations. The suggested experiments have been carried out by students and presented to varied audiences in science fairs.
keywords
Firecrackers and chemistry, rockets and chemistry, pyrotechnics chemistry.
Introducción
Sin ninguna duda, la aplicación de la química más lúdica y que durante siglos ha provocado (y sigue provocando) más asombro y diversión en todas partes del mundo es la relacionada con los fuegos artificiales. En estos espectáculos arden todo tipo de
artículos pirotécnicos responsables de originar chispas brillantes, cascadas de colores y sonidos estruendosos.
Desde el punto de vista de la química, todos los artículos pirotécnicos están formados básicamente por la mezcla íntima de una sustancia que aporta oxígeno
y actúa como agente oxidante (nitrato de potasio, clorato de potasio, etc.) y varios combustibles que actúan como agentes reductores (carbón vegetal, azufre, hierro, magnesio, etc.). Cuando se aplica calor y se supera la energía de activación, se produce una reacción de transferencia de
ISSN 2013-1755, SCQ-IEC Educació Química EduQ número 18 (2014), p. 44-51 DOI: 10.2436/20.2003.02.134 http://scq.iec.cat/scq/index.html 44
electrones (óxido-reducción). Los átomos de los combustibles ceden electrones a los átomos del oxidante. Como consecuencia, se forman nuevos enlaces entre los átomos del reductor y los átomos de oxígeno liberados por el oxidante, originando un producto más estable y liberando energía en diferentes formas (calorífica, luminosa, mecánica).
Aunque los artificios pirotécnicos se utilizan habitualmente con fines recreativos y de entretenimiento, explotando el atractivo que tienen para los estudiantes de cualquier nivel, pueden ser utilizados como un sorprendente recurso didáctico para la química con el fin de aumentar el interés hacia esta ciencia y generar futuras vocaciones.
Los artefactos pirotécnicos más conocidos y utilizados son el tradicional petardo y el clásico cohete. Por su sencillez, pero con sus siempre sorprendentes efectos trueno y propulsor, es posible sacarles provecho en el aula como aplicación y demostración de principios fundamentales de la química, a la vez que para realizar un estudio estequiométrico de las reacciones químicas implicadas.
En química, como en toda actividad que implique cierto riesgo, es necesario seguir siempre unas normas básicas de seguridad y tener presente el proverbio «Seguridad es felicidad». Por esta razón, en las experiencias se han utilizado los petardos y cohetes más pequeños dentro de la categoría 2, de baja peligrosidad, que ni son muy potentes ni muy ruidosos. Aunque la carga de pólvora negra que contienen es muy pequeña (en general, no excede de varias décimas de gramo), es conveniente utilizar guantes y gafas de seguridad y, cuando sea necesario, una cápsula de seguridad de plástico resistente como pantalla protectora. En algunas experiencias se ha utilizado una
claraboya de metacrilato de alta densidad, empleadas en la construcción para aprovechar la luz natural; en otras, una cúpula de policarbonato, que recubren y protegen las bombillas de las farolas. Las experiencias que se explican han sido mostradas en diversos eventos científicos (fig. 1).
El último de ellos fue el IV Finde Científico, organizado en el Museo Nacional de Ciencia y Tecnología (Madrid, 2013).
no) como consecuencia de reacciones químicas exotérmicas. Cuando se unen varios petardos entre sí mediante un estopín pirotécnico (mecha), se forma una traca.
El componente principal de todos los petardos es la pólvora, producto responsable de originar el efecto trueno causado por la ignición de la mezcla pirotécnica comprimida. Para analizar su contenido, rompemos el cilindro


Petardos, pólvora y energía
Según el Reglamento de artículos pirotécnicos (BOE n.º 113, de 8 de mayo de 2010), un petardo es un artificio que contiene materia detonante destinada a producir un efecto sonoro (efecto true-
de cartón que forma el petardo. Se puede observar que contiene dos tipos de sustancias: una es un polvo de color negro, la pólvora negra, que se encuentra entre otra sustancia, arcilla blanca (bentonita) o yeso, que no inter-
Monografia / Recursos didàctics 45 Petardos, cohetes y mucha química
Figura 1. Demostraciones de química y pirotecnia en el IV Finde Científico.
Figura 2. Componentes de un petardo.
viene químicamente, pero sí físicamente. La mecha tiene como finalidad llevar el fuego desde el exterior del petardo hasta la pólvora del interior, con el propósito de proporcionar la energía de activación necesaria para la combustión.
Según se cree, la pólvora fue inventada por los chinos y reinventada en Europa durante la Edad Media por el alquimista inglés Roger Bacon. Las proporciones de sus componentes han permanecido prácticamente inalteradas hasta nuestros días: 75 % de nitrato de potasio, 15 % de carbón vegetal y 10 % de azufre (fig. 2). Esta mezcla se caracteriza porque, a partir de 300 ºC, arde muy rápidamente mediante una aportación moderada de energía. Al quemarse, libera aproximadamente 1 300 J en forma de calor por cada gramo de pólvora.
La rápida combustión y la temperatura de los gases liberados (2 500 ºC-3 500 ºC) sitúan la combustión de la pólvora en la categoría de las deflagraciones: combustiones con una velocidad de propagación de la llama comprendida entre 1 m/s y la velocidad del sonido, que en el aire y a 20 ºC es de 340 m/s. Cuando se supera este límite, se denomina combustión supersónica y se clasifica la sustancia como detonante.
La pólvora solo explota si se la comprime fuertemente en un recipiente herméticamente cerrado debido a la violenta formación de gases calientes en expansión, según la reacción global:
2 KNO3 + 3 C + S à K2S + N2 + 3 CO2
Además de las sustancias que aparecen en la reacción, se pueden formar otros subproductos, como, por ejemplo, monóxido de carbono y carbonato de potasio.
Según la reacción anterior, si la combustión del carbono y del
azufre fuese total, 202 g de nitrato (2 moles) se combinarían con 36 g de carbono (3 moles) y con 32 g de azufre (1 mol) para obtener 110 g de sulfuro de potasio (1 mol), 28 g de nitrógeno (1 mol) y 132 g de dióxido de carbono (3 moles). Como consecuencia, la relación estequiométrica de los reactivos, expresada en porcentajes, es la siguiente:
(202 g KNO3 / 270 g pólvora) · 100 = 75 % KNO3
(36 g C / 270 g pólvora) · 100 = 13 % C
(32 g S / 270 g pólvora) · 100 = 12 % S
Químicamente, la proporción exacta para la pólvora negra es: 75 % de nitrato de potasio, 13 % de carbono y 12 % de azufre. Una pólvora con menor porcentaje en nitrato originaría una combustión más lenta e incompleta, generándose monóxido de carbono.
Los petardos americanos utilizados en estas demostraciones contienen 0,1 g de pólvora. Si consideramos que la pólvora del petardo ha sido elaborada en la proporción clásica (75/15/10), podemos suponer que está compuesta por 0,075 g de nitrato de potasio, 0,013 g de carbón y 0,012 g de azufre. A partir del dato de la energía liberada por gramo de pólvora (1 300 J), resulta que en cada petardo se desprende una energía de 130 J (fig. 3).

Los fabricantes pirotécnicos modifican la velocidad de combustión de la pólvora cambiando parámetros químicos, como las proporciones entre los reactivos, y parámetros físicos, como el tamaño y la uniformidad del grano. Cuanto más finos sean los granos, mayor superficie de contacto habrá y más rápida será la combustión. Se puede decir que preparar una buena pólvora es tanto un arte como una ciencia.
Estequiometría de la combustión de la pólvora
El combustible fundamental que forma parte de la pólvora clásica es el carbón vegetal. La mayor parte de los residuos que deja la combustión de la pólvora negra en forma de humo son cenizas de carbón, que puede llegar hasta el 50 % de la masa inicial de la pólvora. Esto causaba que, durante las batallas en que se empleaba pólvora negra para disparar armas de fuego, se creara en el ambiente una gran humareda que dificultaba la visión de las posiciones del enemigo. Además, dejaba residuos en el cañón del arma, lo que hacía necesaria una limpieza frecuente para evitar su corrosión. Por estas razones, se creó otro tipo de pólvoras, denominadas sin humo, basadas en la nitrocelulosa, que no dejaban prácticamente residuos sólidos, por lo que no tenían los inconvenientes anteriores.
El segundo combustible de la pólvora, el azufre, es un elemento sólido de color amarillo que tiene como función mejorar la estabilidad de la mezcla y aumentar la velocidad de propagación de la combustión. El azufre funde a 115 ºC y tiene una temperatura de ignición más baja que el carbón vegetal, sobre 250 ºC, lo que favorece que la pólvora empiece a arder.
46 Educació Química EduQ número 18
Figura 3. Diagrama energético de la combustión de la pólvora negra.
Coordenada de reacción
En el siguiente experimento es posible comprobar el comportamiento químico de los dos combustibles en presencia del oxígeno del aire:
— Añadir 1 g de carbón vegetal en una cápsula de porcelana y hacer lo mismo en otra cápsula con 1 g de azufre. Al acercar la llama de una cerilla, no se observa que se inicie la combustión en ninguno de los casos.
— A continuación, aumentar la temperatura calentando las cápsulas con un mechero Bunsen. En la cápsula del carbón vegetal, se observan unas pequeñas chispas y humo. En el caso del azufre, primero se funde y posteriormente aparece una pequeña llama azulada, desprendiéndose dióxido de azufre. Este es un gas irritante para el sistema respiratorio, por lo que es recomendable hacerlo en un lugar bien ventilado o bajo una campana de seguridad. En ambos casos, la combustión se produce, pero con una velocidad de reacción muy baja.
Las reacciones de la combustión del carbono y del azufre son las siguientes:
C (s) + O2 (g) à CO2 (g) ∆H = −396 kJ/mol S (s) + O2 (g) à SO2 (g) ∆H = −297 kJ/mol
Un aumento en la concentración del oxígeno ocasionará un aumento en la velocidad de reacción, favoreciéndose la combustión y haciéndola más rápida y vigorosa, si bien la cantidad total de energía desprendida seguirá siendo la misma. Para conseguir este efecto, se añade un comburente, el nitrato de potasio (salitre), un fuerte oxidante que aporta el oxígeno necesario para una rápida y total combustión, según la reacción endotérmica:
2 KNO3 (s) à 2 KNO2 (s) + O2 (g)
∆H = 124,8 kJ/mol
Si en lugar del nitrato de potasio se utiliza un oxidante más fuerte, como el clorato de potasio, los combustibles arden más rápidamente y con mayor poder explosivo. Este efecto se explica porque el clorato, que funde a 368 ºC, cede todo el oxígeno que contiene (el nitrato solo cede una tercera parte) durante su descomposición a temperaturas superiores a 400 ºC.
2 KClO3 (s) à 2 KCl (s) + 3 O2 (g) ∆H = −38,8 kJ/mol
— En presencia de un comburente que proporcione más oxígeno, en vez de arder lentamente, se produce una rápida combustión acompañada de chispas doradas y de un humo gris, causado por el carbono que no ha reaccionado (fig. 4).
La reacción que tiene lugar en la mezcla de carbón y clorato de potasio fundido es la siguiente:
2 KClO3 (s)+ 3 C (s) à 2 KCl (s) + 3 CO2 (g) ∆H = −1 265,6 kJ/mol

De las ecuaciones de descomposición de ambos reactivos se deduce que, por cada 2 moles de nitrato, se desprende 1 mol de oxígeno, y en la descomposición de 2 moles de clorato, se originan 3 moles de oxígeno.
Para comprobar el efecto del comburente sobre el carbón y el azufre, se repite el experimento anterior, pero en esta ocasión añadiendo el oxígeno que proporciona el clorato de potasio descompuesto:
— Añadir a una cápsula de porcelana que contenga aproximadamente 1 g de carbón vegetal una cucharada pequeña con una pizca (unos 0,5 g) de clorato de potasio, previamente calentado y fundido con la llama de un mechero Bunsen.
— Ahora, en el interior de una campana de seguridad, añadir otro poco de clorato de potasio fundido a la cápsula que contiene una pizca de azufre (unos 0,5 g). En este caso, se produce una fulgurante y luminosa combustión.
2 KClO3 (s) + 3 S (s) à 2 KCl (s) + 3 SO2 (s) ∆H = −968,6 kJ/mol
La reacción global de la combustión total de la pólvora formada por los tres componentes anteriores y la entalpía de la reacción se obtiene de la suma de las combustiones parciales del carbono y del azufre, de acuerdo con la ley de Hess.
4 KClO3 (s) + 3 C (s) + 3 S (s) à 4 KCl (s) + 3 CO2 (g) + 3 SO2 (g) ∆H = −2234,2 kJ/mol
Monografia / Recursos didàctics 47 Petardos, cohetes y mucha química
Figura 4. Combustión del carbón vegetal combinado con clorato de potasio.
De la estequiometría de la reacción se pueden establecer las cantidades exactas de combinación entre los reactivos: 490 g de clorato (4 moles) reaccionan con 36 g de carbono (3 moles) y con 96 g de azufre (3 moles). Con estas cantidades se elaboraría una mezcla de 622 g, de la que se deducen los porcentajes estequiométricos teóricos para la pólvora elaborada con clorato de potasio:
(490 g KClO3 / 622 g pólvora) · 100 = 78,8 % KNO3
(36 g C / 622 g pólvora) · 100 = 5,8 % C
(96 g S / 622 g pólvora) · 100 = 15,4 % S
Si repetimos los cálculos realizados para el petardo que contenía 0,1 g de pólvora negra, pero sustituyendo el nitrato por clorato de potasio y utilizando la nueva relación (78,8/5,8/15,4), se puede concluir que estaría compuesta por 0,0788 g de clorato de potasio, 0,0058 g de carbono y 0,015 g de azufre. Con el dato de la entalpía de la reacción, se obtiene que la energía liberada es casi el triple que la energía desprendida por la pólvora negra, demostrándose que la pólvora gris libera mucha más energía que la negra.
0,0058 g C · (1 mol C / 12 g C) · (2 234,2 · 103 J / 3 mol C) = 360 J
¿Por qué explota un petardo?
Para comprender por qué explota un petardo, doblamos uno de ellos por la mitad y lo abrimos sin que se lleguen a separar las dos partes, de forma que la pólvora quede a ambos lados del cilindro abierto. Colocamos el petardo sobre una cápsula de porcelana y encendemos la mecha. Un par de metros de distancia de seguridad son suficientes en esta demostración.
Después de arder la mecha durante unos 4 s, observamos
que no se produce la explosión de la pólvora: simplemente se produce una pequeña llamarada (fig. 5). Es importante comprobar que, al doblar y abrir el petardo, la pólvora se encuentre justo en esa zona. De esta forma, los gases generados durante la combustión no se encuentran comprimidos y son liberados a presión atmosférica.

Como conclusión, la pólvora sin comprimir arde rápidamente, pero si se comprime fuerte mente, como en los petardos, donde se encuentra aprisionada por un cilindro de cartón y un sólido inerte (arcilla), explota a consecuencia de la formación de gases a elevada presión y temperatura. Este efecto es similar a la explosión de un globo que no soporta la excesiva presión que ejerce el aire cuando se ha inflado demasiado.
— Mezclar bien una pizca de azufre (unos 0,5 g) con otra pizca de clorato de potasio sobre una superficie resistente (piedra de granito). Dividir la mezcla en dos partes aproximadamente iguales, separadas por una distancia suficiente para que no reaccionen simultáneamente. Es importante no utilizar cantidades mayores a las indicadas para que la experiencia sea segura.
— Con guantes y gafas de seguridad, aproximar la llama de una cerilla o mechero a una de las porciones preparadas. Se observa que la mezcla arde rápidamente, liberando calor, luz y humo.
— Repetir el procedimiento con la otra porción de la mezcla, pero, en esta ocasión, golpeándola con un martillo.
— En este caso, se produce una estruendosa reacción.
Curiosamente, la energía liberada es la misma que en la porción que ha ardido, pero, al hacerlo de forma instantánea, se origina una onda expansiva a causa de la explosión. Al golpear la mezcla, hay que ponerse cascos para proteger los oídos del ruido y el resto debe dejar una distancia de seguridad para atenuar el sonido de la deflagración.

El efecto explosivo de la pólvora se puede comprobar con solo dos de sus componentes, el azufre y el clorato de potasio (fig. 6 y 7):
El azufre, al mezclarse con el clorato, forma una mezcla sensible a los golpes y a la fricción, pudiendo originar una reacción explosiva.
48 Educació Química EduQ número 18
Figura 5. Combustión de un petardo abierto.
Figuras 6 y 7. Combustión y explosión de azufre con clorato de potasio.
Pólvora y extinción de fuego
Parece contradictorio que una sustancia como la pólvora pueda sofocar un incendio. Sin embargo, al igual que para apagar pozos petrolíferos en llamas se emplean explosivos, se pueden apagar algunos tipos de fuego con pólvora. De hecho, existen en el mercado extintores que basan su efecto en una pequeña carga de pólvora que, al arrojarse a un fuego incipiente y explotar, asfixian el fuego. Simultáneamente, extienden un producto extintor que impide que este se reanude.
Es fácil demostrar el efecto de extinción de la pólvora sobre el fuego mediante una sencilla experiencia (fig. 8):
— Colocar verticalmente (con ayuda de un soporte o nuez de laboratorio) unas pequeñas velas dispuestas en círculo sobre una bandeja metálica.

— Después de la explosión del petardo, se comprueba que las velas se han apagado.
Si tenemos en cuenta que la combustión de la pólvora no necesita oxígeno del aire para arder, no podemos deducir que el petardo consume todo el oxígeno del interior de la cápsula y que por esta razón el fuego de las velas se apaga. La explicación radica en la rápida liberación de productos gaseosos incombustibles (dióxido de carbono, nitrógeno, etc.) que ocupan un volumen unas cuatrocientas veces mayor al inicial, apartando el oxígeno de las velas, que no pueden continuar ardiendo y se apagan.
La pólvora puede utilizarse en la extinción de fuego debido a la rápida formación de gases no combustibles, que retiran el oxígeno de la zona del fuego y de esta forma lo asfixian y sofocan.
Combustión bajo el agua
El agua se ha utilizado tradicionalmente como agente extintor de fuego, principalmente debido a su alto calor específico y a su elevado calor latente de vaporización. A priori, parece que no es posible que un petardo situado dentro del agua pueda explotar. Sin embargo, es posible comprobar de forma segura que esto sucede y, además, observar un curioso fenómeno relacionado con transformaciones de energía química en energía física:
co, que puede ser un tubo utilizado en el deporte del tenis para recoger las pelotas o una lámina de plástico resistente y enrollada varias veces sobre sí misma.
— Después de esperar los segundos que tarda la mecha en llegar a la pólvora, el petardo explota dentro del agua e inmediatamente la botella se eleva sobre la superficie (fig. 9).
Hay que dejar que la mecha prenda bien antes de soltar el petardo (de lo contrario, podría apagarse) y nunca se deben utilizar botellas de vidrio, porque podrían estallar.

— Situar verticalmente, en el centro de las velas, un petardo sujetado con otro soporte.
— Encender primero las velitas y, seguidamente, la mecha del petardo. Rápidamente, taparlo todo con una cúpula de seguridad.
— Sujetar un petardo por la parte superior con unas pinzas metálicas y situarlo medio metido en el cuello de una botella de plástico. Se ha utilizado una botella de agua mineral de plástico de 330 mL, llena de agua hasta la mitad, aproximadamente.
— Encender la mecha del petardo y dejarlo caer en el interior de la botella de plástico.
— Rápidamente, cubrir la botella con un cilindro de plásti-
El efecto de la explosión se debe a que la pólvora no necesita oxígeno del aire para arder y explotar, ya que contiene su propio comburente, que le proporciona el oxígeno. Los gases generados en la combustión, al encontrarse en un volumen reducido, salen impulsados hacia arriba, produciéndose una fuerza de reacción que actúa sobre la mesa, la cual ejerce una fuerza normal sobre la botella y, como consecuencia, esta se eleva. En esta experiencia se produce la transformación de energía química, contenida en la pólvora, en energía calorífica y en energía mecánica (cinética y potencial), que adquiere la botella.
Teniendo en cuenta que por cada petardo utilizado se liberan 130 J, si se aprovechase toda esa energía, una botella de 330 mL llena de agua, en teoría, podría elevarse hasta 40 m. En realidad,
Monografia / Recursos didàctics 49 Petardos, cohetes y mucha química
Figura 8. Extinción de llamas por la pólvora de un petardo.
Figura 9. Propulsión de una botella por un petardo.
de toda la energía liberada en la combustión, solo se transforma un porcentaje muy reducido en energía potencial mecánica, el cual no llega al 5 %.
Cohetes y efecto propulsor de la pólvora
Otro de los artículos pirotécnicos más utilizados en las fiestas y celebraciones de todo tipo son los cohetes. A diferencia de los petardos, estos artefactos, antes de explotar, se elevan sobre el suelo. Están fabricados con un cilindro de cartón duro, que contiene dos cargas de pólvora diferentes, unido a una varilla de madera fina, que tiene como finalidad estabilizar su trayectoria y que no se desvíe. En el interior del cohete (fig. 10) se diferencian dos zonas:
— La parte inferior, que no se encuentra cerrada ni comprimida, por donde entra la mecha de encendido y salen los gases de la combustión. La mecha está conectada con la primera carga, formada por 0,2 g de pólvora negra con efecto propulsor.
— La parte superior, comprimida por arcilla blanca, formada por 0,05 g de pólvora gris conectada con la mecha, que produce el efecto sonoro de estampido al
llegar a la máxima altura. La pólvora gris contiene clorato de potasio para dotarla de mayor potencia explosiva.
Cuando la mecha encendida llega hasta el interior del cohete, el calor que transmite enciende la primera carga de pólvora. Los gases liberados, junto con la energía desprendida en la deflagración, se expanden rápidamente, escapando por la salida existente en la parte inferior del cohete. Como consecuencia, y debido a la tercera ley de la dinámica de Newton, se produce simultáneamente una fuerza de reacción en la misma dirección pero en sentido opuesto a la salida de los gases, lo que origina que el cohete salga propulsado hacia el cielo.
Mientras el cohete asciende, por su interior el fuego se sigue propagando hacia la segunda carga de pólvora a través de la mecha. Al llegar a lo más alto del vuelo, se produce la deflagración de la pólvora y, como se encuentra comprimida, en esta ocasión, origina un pequeño estampido. Los cohetes grandes pueden elevarse centenares de metros antes de realizar varias etapas y efectos. En su interior, contienen

Se introducen junto a las cargas de pólvora otras sustancias pirotécnicas, como metales pulverizados y sales metálicas
unos pequeños tubos rellenos de pólvora o mechas de retardo, que facilitan la transmisión del fuego de una etapa a otra. Modificando la composición de las mechas de retardo, se puede ajustar con precisión el retardo entre las fases, que puede variar de 1 a 8 s. Para que se produzcan diferentes efectos explosivos (estrellas luminosas, luces brillantes, colores espectaculares, etc.) en cada etapa, se introducen junto a las cargas de pólvora otras sustancias pirotécnicas, como metales pulverizados y sales metálicas.
Para analizar el efecto propulsor de la pólvora contenida en un pequeño cohete, se propone la siguiente experiencia:
— Pegar un cohete con cinta adhesiva a la parte superior de un pequeño coche. Acortar la varilla del cohete para que no interfiera en el movimiento.
— A continuación, colocar el coche en el extremo de un cilindro de plástico resistente, de 1 m de longitud, con el extremo final cerrado pero agujereado para que los gases puedan salir.
— Encender el cohete. Al arder la primera carga de pólvora, se produce la salida de los gases de la combustión por la tobera inferior del cohete. Como resultado, y de acuerdo con la ley de acción–reacción, el coche es impulsado hacia delante, avanzando por el interior del cilindro de plástico (fig. 11). Seguidamente, la mecha prende la segunda carga de pólvora y tiene lugar una pequeña deflagración en el interior del tubo protector.
Es posible medir la velocidad que transmite el cohete al coche
50 Educació Química EduQ número 18
Figura 10. Interior de un pequeño cohete pirotécnico.

utilizando un sistema de puertas fotoeléctricas. Con este dato y la masa del coche, se puede calcular la energía cinética adquirida y el rendimiento energético del proceso, que también es bastante reducido.
En otra experiencia se puede analizar el efecto propulsor de la pólvora utilizando como propelente pólvora sin humo (trinitrato de celulosa) en forma de papel o algodón. Este compuesto contiene suficiente oxígeno para convertir totalmente los productos de la combustión en gases (CO, CO2, H2O y N2) (fig. 12).
— Introducir una pequeña bolita de papel de nitrocelulosa en el fondo de un tubo de ensayo, cerrando el extremo con un tapón de corcho que lleva incorporada en el exterior una varilla para simular que es un cohete.
— Sujetar con unas pinzas de madera el tubo de ensayo y

calentar la base con la llama de un mechero Bunsen.
— A los pocos segundos, en el interior del tubo se produce una repentina y sorpresiva combustión, seguida de la propulsión del tapón a varios metros de distancia, causada por la presión generada por los productos gaseosos formados.
Conclusiones
La pirotecnia está rodeada de un halo mágico, atrae la atención, provoca fascinación y genera admiración, por lo que es un excelente recurso didáctico para la enseñanza de la química en todos sus niveles. Difícilmente se pueden encontrar experiencias y demostraciones más atractivas para los estudiantes que las relacionadas con los efectos pirotécnicos. De esta forma, utilizando el asombro como método de aprendizaje, se abren caminos para llegar más fácilmente hasta el conocimiento, a la vez que se consigue mayor motivación, aumentar las ganas de aprender y estimular futuras vocaciones. Muchas carreras científicas se han iniciado bajo el estímulo del atractivo de experimentos pirotécnicos realizados durante la juventud. La enseñanza de la química del siglo xxi debe estar rodeada de ilusión, imaginación y belleza.
Bibliografía
conkling, J. A. (1990). «Pirotecnia». Investigación y Ciencia, n.º 168, p. 58-65.
courty, J.; kierlik, E. (2003). «300 estrellas de artificio». Investigación y Ciencia, n.º 324, p. 84-85.
cHAng, R. (1999). Química. 6.ª ed. México: McGraw-Hill.
Ford, A. (1993). Chemical magic. Nueva York: Dover.
PArtington, J. R. (1999). A history of Greek fire and gunpowder. Baltimore: Johns Hopkins University Press.
PerAl, F.; troitiño, M.; Cruz, M.; PlAzA, M. (2003). Didáctica de la química y vida cotidiana: Química de los fuegos artificiales Madrid: ETS Ingenieros Industriales.
PrAdA, F. (2006). «El fuego: química y espectáculo». Anales de la Real Sociedad Española de Química, vol. 102, n.º 2, p. 54-59.
— (2009). «El fuego como luminoso recurso didáctico». Educació Química EduQ, n.º 2, p. 11-15.
— (2013). «Fundamento científico de los artículos pirotécnicos». Revista Eureka, vol. 10, n.º 2, p. 273-281.

Fernando Ignacio de Prada Pérez de Azpeitia
Es jefe del Departamento de Física y Química del IES Las Lagunas de Rivas (Madrid). Ha participado en eventos científicos divulgativos y en cursos para profesores en museos de ciencia y de arte. Es autor y coautor de trabajos y artículos en diversas revistas científicas, así como de libros de texto de física y química.
C. e.: pradaperez@hotmail.com
Monografia / Recursos didàctics 51 Petardos, cohetes y mucha química
Figura 12. Efecto propulsor de nitrocelulosa en un tubo de ensayo.
Figura 11. Efecto propulsor de un cohete unido a un coche.
Un espectacle de química amb productes quotidians
A chemistry show using everyday chemical products
Josep Corominas / Escola Pia de Sitges. Departament de Ciències
resum

En parlar de productes químics, molta gent s’imagina productes de laboratori emprats en experiments complicats o substàncies que són tot el contrari de les «naturals», però la realitat no és aquesta. La química es troba en els productes i els materials que usem a casa: per a la neteja, per a l’alimentació, a la farmaciola o per al jardí. Tots són «productes químics». En aquest article es proposen diferents experiments que evidencien que hi ha reaccions, de vegades sorprenents, amb coses que fem servir cada dia.
paraules clau
Productes químics, reaccions químiques, química quotidiana.
abstract
When speaking about chemicals, a lot of people imagine laboratory products used in complicated experiments or substances that are quite the opposite of «nature». The reality, however, is different. Chemistry is in the products and the materials that we use at home: for cleaning, for food, in the first aid kit or in the garden. Everything is chemical. In this article we propose different experiments to demonstrate that there are reactions, sometimes amazing, with materials that we use every day.
keywords
Chemicals, chemical reactions, everyday chemistry.
«De què ens serveix fer ciència, si després no la sabem explicar d’una manera planera?». Frase de Niels Bohr a l’obra Copenhaguen, de Michael Frayn
Quina necessitat hi ha de fer «divulgació científica»?
La divulgació de la ciència és un aspecte més de l’ensenyament de la ciència i de la formació d’una cultura científica. Una part de la cultura que s’espera d’una societat té a veure amb la comprensió de la ciència. S’ha tardat segles de lluita cultural, social, econòmica i política per construirla i és un treball en constant progrés. Tot el que els divulgadors de la ciència poden fer és seguir
construint ponts entre els experts i el públic, de manera que aquestes idees de cultura científica vagin arrelant en la societat. Per això cal presentar una valoració oberta i sincera de l’estat de la ciència i dels seus usos dins la política i la societat. La ciència no està aparcada fora de la societat, sinó que n’és una part integral. Així, doncs, el paper de la divulgació científica és traduir els descobriments, conceptes, teories, fenòmens, etc., en paraules que persones profanes però amb ganes de saber puguin entendre. Massa sovint els científics prefereixen dirigir-se exclusivament als seus col·legues o, quan volen ferho al públic en general, ho fan de
manera prou difícil fins i tot per als qui realment volen entendre la ciència.
A diferència, però, del que implica l’ensenyament a l’aula, la divulgació de la ciència no acostuma a tenir una fase de diàleg intens amb el públic, a causa del poc temps de què es disposa per a les demostracions (sovint es fan en una hora o menys). En el cas de la química, en general, es realitzen unes quantes demostracions més o menys espectaculars. Malgrat aquestes limitacions, és convenient una planificació acurada i tenir presents les consideracions següents:
— És millor presentar una seqüència de demostracions sota un
ISSN 2013-1755, SCQ-IEC Educació Química EduQ número 18 (2014), p. 52-56 DOI: 10.2436/20.2003.02.135 http://scq.iec.cat/scq/index.html 52
esquema comú que no un seguit d’experiments desconnectats, per més espectaculars que siguin.
— Òbviament, cal tenir en compte a quin públic ens adrecem. No és el mateix un auditori de gent de totes les edats que un públic de joves de pocs anys.
— Sempre que sigui possible, convé emprar materials i productes d’ús quotidià. Això té una especial rellevància en química: el fet d’emprar productes que trobem habitualment a casa o a les botigues ajuda a entendre que la ciència (i, especialment, la química) no és una qüestió exclusiva de matrassos i substàncies de noms estranys.
— No totes les demostracions han de ser d’una gran espectacularitat. El terme exocharmic, emprat per Shakhashiri (1983), significa usar tant l’aspecte recreatiu i de vegades «màgic» com una metodologia per atreure l’atenció, impressionar algun cop i crear l’oportunitat de fer reflexionar científicament.
— Un experiment no «fracassa» mai. Aquest principi és bàsic en qualsevol demostració, sigui a l’aula o davant d’un auditori. Pot ser que esperéssim un resultat determinat i obtinguem un efecte inesperat. És fonamental saber explicar que calia tenir en compte determinats factors que no havíem previst.
Un espectacle de química amb productes quotidians Aquest espectacle consta d’un conjunt d’experiments que s’han presentat en diverses ocasions a públics molt variats. Consisteix a presentar diferents productes comercials tot indicant quina és la substància «activa» que els dóna les característiques que en determinen l’ús. Amb la col·lecció de productes, es fa un recorregut pels diferents tipus de reaccions químiques, les propietats dels materials i les relacions entre les
propietats i l’estructura de les substàncies.
La sessió està dedicada a la química que es pot fer amb productes que trobem a les prestatgeries del supermercat: dissolvents, productes de neteja, verdures, joguines senzilles, material escolar i d’altres. Es posa de manifest que hi ha reaccions, de vegades sorprenents, amb materials que fem servir cada dia. Tot seguit es presenta una llista, no exhaustiva, de diferents subs-
Què trobem al supermercat?
tàncies, solucions i objectes amb els quals es pot fer un curs complet de química. I això sense tenir en compte els substàncies químiques que podem descobrir fent una lectura de les etiquetes dels productes (Mans, 2006) (fig. 1).
Tot seguit es presenten alguns experiments, per als quals s’indica el material que s’utilitza i la manera com cal procedir, que constitueixen part de l’espectacle de química amb productes quotidians.
Amb la «llista de la compra» següent, es pot fer tot un curs de química... i encara s’hi podrien afegir més coses!
— Secció de productes de neteja: acetona, KH7© (NaOH), Viakal© (HCl), amoníac, salfumant (HCl 20 %), desembussadors (H2SO4), sosa càustica (NaOH), metanol, productes «anticalç» (àcid fosfòric), ambientadors...
— Secció de fruites i verdures: pomes, plàtans, fruits secs, col vermella...
— Secció de jardineria, lleure i manteniment de piscines: sulfat de coure, roig de fenol, adobs per a les plantes [clorur de ferro (III), nitrat de potassi i nitrat d’amoni], mànegues de PVC, carbó...
— Secció de material escolar: cartolines, caixes de poliestirè, metalls diversos (zinc, alumini, magnesi a les maquinetes per fer punta), llapis...
— Secció de cosmètica i parafarmàcia: elixirs bucals concentrats (etanol 55 %), povidona iodada, suplements vitamínics de vitamina C, clorat de potassi, comprimits efervescents, etanol, cotó, aigua oxigenada (3 %), bastonets de cotó...
— Secció de joguines i festes familiars: globus, cotxes de joguina, vasos i copes de poliestirè...
— Secció de pastisseria: colorants alimentaris, sucre.
— Secció de ferreteria: cables elèctrics (coure), acer, ferro, alumini, polímers diversos.
— Seccions diverses: oli, vinagre (àcid acètic 1 M), sal (NaCl), bicarbonat (NaHCO3), sal sense sodi (KCl), cúrcuma (al curri).
— A prop de les caixes: encenedors de butà, llumins, piles...

Figura 1. Etiquetes que mostren les substàncies [àcid fosfòric, clorur de calci i sulfat de coure (II)] que contenen alguns productes comercials.
Monografia / Recursos didàctics 53 Un espectacle de química amb productes quotidians
Canvis de colors amb l’amoníac o amb l’hidròxid de sodi
Aquesta demostració il·lustra els canvis de colors dels indicadors àcid–base.
Material: CuSO4 (solució 1 M), amoníac, KH7©, Viakal©, paper blanc, indicadors (roig de fenol, suc de col vermella, cúrcuma).
Es retallen flors d’una cartolina i es pinten amb fenolftaleïna, de manera que es tornen de color fúcsia quan es mullen amb un producte de neteja que contingui hidròxid de sodi, com el KH7©, i retornen al color blanc original quan es mullen amb un àcid, com el Viakal©
La fig. 2 mostra l’aspecte d’un paper amb el dibuix d’un jugador de futbol abans i després d’introduir-lo dins una bossa de plàstic transparent, que tanqui bé, on hi ha un paper mullat amb amoníac. Els dibuixos es pinten amb antelació amb l’ajuda de pinzells i es deixen assecar abans d’introduir-los a la bossa. Els canvis de colors que es produeixen són els següents: el sulfat de coure es torna d’un blau intens, per formació del compost de coordinació entre NH3 i els ions Cu2+; el colorant cúrcuma passa a taronja intens, i el suc de col vermella canvia a un color vermell intens. En treure el paper de la bossa, l’amoníac s’evapora i el dibuix perd els colors. Es pot tornar a usar el mateix
En treure el paper de la bossa, l’amoníac s’evapora i el dibuix perd els colors. Es pot tornar a usar el mateix dibuix diverses vegades. La pilota del jugador està representada per l’estructura d’un ful·lerè. Cal tenir precaució amb l’amoníac i no respirar-ne els vapors

dibuix diverses vegades. La pilota del jugador està representada per l’estructura d’un ful·lerè. Cal tenir precaució amb l’amoníac i no respirar-ne els vapors.
Coets
En aquesta demostració, la generació d’un gas en una reacció química s’utilitza per impulsar la tapa d’un petit recipient, a la qual s’enganxa un tros de porexpan retallat amb forma de coet.
Material: recipient amb tap unit a un tros de porexpan que imita la part superior d’un coet, comprimits efervescents, cronòmetre.
Els comprimits efervescents generen diòxid de carboni quan es posen en contacte amb l’aigua. Aquest gas es forma per reacció entre un àcid (àcid cítric) i una base (hidrogencarbonat de sodi), substàncies que es troben als comprimits.
Si es fa la reacció en un recipient tancat amb un tap, el gas generat fa pressió fins que les forces de pressió superen la força de fricció que subjecta el tap, el qual surt disparat. El temps que tardi a saltar el tap ens indicarà la velocitat de formació del gas CO2.
Les reaccions que es produeixen són les següents:
HOC(CH2COOH)2COOH (aq) + H2O (l)
→ (HOC(CH2COOH)2COO)− (aq) + H3O+ (aq)
NaHCO3 (s) → Na+ (aq) + HCO3− (aq)
HCO3− (aq) + H2O (l) → H2CO3 (aq) + OH− (aq)
H2CO3 (aq) → H2O (l) + CO2 (g)
Estrelles naixents
En aquest experiment es mostra la descomposició tèrmica d’un clorat.
Material: clorat de potassi, càpsula metàl·lica, bec de Bunsen, carbó en pols. (Cal portar ulleres de seguretat.)
S’escalfa el clorat de potassi a la càpsula fins a fondre’l i s’aboca damunt de carbó en pols (fig. 3).
La reacció de descomposició del clorat de potassi forma oxigen i es produeix també una reacció secundària de dismutació en perclorat i clorur.
2 KClO3 (s) → 2 KCl (s) + 3 O2 (g) 4 KClO3 (s) → 3 KClO4 (s) + KCl (s)

3. Descomposició tèrmica d’un clorat.
Si es vol generar un gran volum d’oxigen, cal afegir una part
54 Educació Química EduQ número 18
Figura 2. Canvis de colors d’indicadors en presència d’amoníac.
Figura
igual de diòxid de manganès (MnO2) o d’òxid de ferro (II) (Fe2O3) al clorat de potassi abans d’escalfar-lo. D’aquest manera, la reacció és més regular, no es forma perclorat i s’inicia a una temperatura més baixa.
Mànega d’acetona
Per dur a terme l’experiment, cal situar un tub en posició vertical, però amb una certa inclinació. A prop de la boca inferior, es deixa una espelma encesa.
Material: tub transparent de PVC d’entre 1,5 i 2 m de llarg i entre 3 i 4 cm de diàmetre, comptagotes, propanona («acetona»), espelma. (Cal mantenir el flascó de l’acetona lluny de les flames i tapat, ja que és molt inflamable.)
Amb l’ajuda del comptagotes, es deixen caure unes gotes de propanona a la boca superior del tub procurant que llisquin per les parets.
Esperem uns instants. Es genera una flama blava que recorre el tub des de l’espelma fins a la boca superior, la qual cosa posa en evidència:
— Que l’acetona és molt volàtil: les gotes que s’han vessat a la part superior del tub «desapareixen».
— Que el vapor d’acetona és més dens que l’aire: va baixant pel tub fins a sortir per la boca inferior i trobar la flama de l’espelma.
— Que és molt inflamable.
— Que els gasos de combustió
estan prou calents i són menys densos que l’aire, perquè ascendeixen pel tub fins a la boca superior.
Volatilitat dels líquids
Aquesta demostració permet relacionar les propietats d’un líquid amb la seva estructura i amb les forces intermoleculars.
Material: globus, comptagotes, vas de precipitats de 1 000 mL amb aigua calenta (entre 60 ºC i 80 ºC), líquids per investigar: aigua, propanona («acetona»), gasolina, etanol...
Per realitzar-la, es mesura 1 mL de cadascun dels líquids amb el comptagotes i es posa dins de cada globus desinflat. Es lliguen els globus amb els líquids a l’interior i es col·loquen dins el vas de precipitats amb aigua calenta. Cal observar quin és el globus que es va inflant més. Com més volàtil sigui el líquid, més s’inflarà el globus.
Espelma comestible
Damunt de la taula, amb sal i poca llum, es posa un plat amb unes espelmes enceses. Agafem una de les espelmes i ens la mengem!
Material: espelmes blanques de cera, plàtans i pomes, ametlles, foradador de taps.
L’espelma comestible es prepara amb un cilindre de plàtan o de poma. Cal netejar bé el material abans de fer-lo servir (fig. 4a). El ble d’aquesta espelma comesti-
Si es posen juntes les espelmes autèntiques i les falses, l’efecte sobre el públic és més impressionant. Cal assegurar-se que ens mengem una de les espelmes falses i no una de les no comestibles i també cal apagar la flama abans de posar-se l’espelma a la boca
ble serà un tros d’ametlla natural o torrada. Els fruits secs tenen un alt contingut en olis, que són bons combustibles.
Si es posen juntes les espelmes autèntiques i les falses, l’efecte sobre el públic és més impressionant (fig. 4b i 4c). Cal assegurar-se que ens mengem una de les espelmes falses i no una de les no comestibles i també cal apagar la flama abans de posar-se l’espelma a la boca.
El foc artista
Aquesta demostració il·lustra un sorprenent fenomen químic que es produeix perquè hi ha substàncies que «cremen» sense la necessitat d’oxigen.
Material: solució concentrada de nitrat de potassi (KNO3), paper, pinzell fi.
Per fer aquesta demostració, es pinta en un paper blanc el contorn d’una figura o bé s’hi escriu

Monografia / Recursos didàctics 55 Un espectacle de química amb productes quotidians
Figura 4. a) Una bona manera de preparar cilindres de poma; b) i c) cinc espelmes comestibles i no comestibles abans i després d’encendre-les.
a) b) c)

5. Les figures d’animals es fan visibles en cremar-se el paper.
un missatge amb el pinzell mullat en la solució de nitrat de potassi. Es deixa assecar. S’acosta la punta d’una vareta d’encens encesa a qualsevol zona pintada del paper. A poc a poc, apareixerà el dibuix, de manera que sembla que l’està fent el foc que va cremant lentament el paper.
Tots els nitrats són inestables i es descomponen alliberant oxigen (reacció semblant a la dels clorats descrita en un experiment anterior). El procés és molt exotèrmic, ja que allibera prou calor per anar cremant el paper, però només a la zona on hi ha el nitrat (fig. 5).
Consideracions finals
Les demostracions de química es poden classificar com a «experiències educatives» que els professors poden emprar per estimular el desenvolupament del pensament científic dels estudiants. Si, a més, els materials i les substàncies que fem servir són coneguts per tothom perquè és habitual trobar-los a casa o en botigues, és molt més probable que siguin acollides favorablement, alhora que un bon punt de partida per ajudar a fomentar el coneixement científic. També és molt adient utilitzar-les en activitats de divulgació per al públic en general.
Les demostracions de química es poden classificar com a «experiències educatives» que els professors poden emprar per estimular el desenvolupament del pensament científic dels estudiants
Bibliografia
corominAs, J. (2007). «Densitat i colors». Ciències: Revista del Professorat de Ciències de Primària i Secundària [recurs electrònic], núm. 6, p. 6-7. <http:// ddd.uab.cat/pub/ ciencies/16996712n6p6.pdf> [Consulta: 30 maig 2014]
— (2011). «Fiesta química: licores que no lo son, bebidas que no hay que beber y alguna cosa de comer». Revista Eureka sobre Enseñanza y Divulgación de las Ciencias [recurs electrònic], vol. 8, núm. extra, p. 454-459. <http://rodin.uca.es/xmlui/ bitstream/handle/10498/ 14551/12-Corominas-454-459. pdf?sequence=7> [Consulta: 30 maig 2014]
— (2013). «Actividades experimentales POE en la enseñanza de la química y de la física».
Alambique: Didáctica de las Ciencias Experimentales, núm. 74, p. 69-75. krAmers-PAls, H. [et al.] (2008). Showdechemie. Utrecht: NVON. mAns, C. (2006). Els secrets de les etiquetes. Barcelona: Mina. o’Brien, T. (1991). «The science and art of science demonstrations». J. Chem. Ed., vol. 68, núm. 11, p. 933-936. roesky, H. W.; möckel, K. (1996). Chemical curiosities. Weinheim: Wiley-VCH.
— (2007). Spectacular chemical experiments. Weinheim: Wiley-VCH. sHAkHAsHiri, B. Z. (1983). Chemical demonstrations: A handbook for teachers of chemistry. Vol. 1. Madison: University of Wisconsin Press.
Webgrafia
http://reuredc.uca.es/index.php/tavira/article/view/243
http://centros5.pntic.mec.es/ies.victoria.kent/Rincon-C/practica2/pr-77/ pr-77.htm

Josep Corominas Viñas És llicenciat en ciències químiques per la Universitat de Barcelona i professor de Física i química a l’Escola Pia de Sitges. Ha impartit cursos de formació del professorat, és autor d’articles sobre treballs pràctics de química i ha col·laborat en llibres de didàctica de la química. Ha guanyat premis i ha obtingut una menció honorífica en l’especialitat de demostracions de química a Ciencia en Acción. És un dels coordinadors del projecte «Química en context» del CESIRE del Departament d’Ensenyament i col·laborador del CRECIM de la Universitat Autònoma de Barcelona. A/e: jcoromi6@xtec.cat
56 Educació Química EduQ número 18
Figura
El vi com a recurs didàctic
The wine as a didactic resource
José Antonio Martínez Pons / IES Las Lagunas. Rivas (Madrid) / Universitat Antonio de Nebrija (Madrid)
resum

Amb el vi com a fil conductor, es proposa un conjunt d’experiències adreçades a l’ensenyament secundari, fàcilment ampliables per a estudiants universitaris. Algunes són l’adaptació de tècniques enològiques de fàcil realització i baix cost i, en alguns casos, es realitzen amb instruments de mesura casolans construïts pels alumnes. Les experiències ajuden a integrar alguns fenòmens de la química i de la física a la metodologia de les proves de control de qualitat de la cultura vinícola.
paraules clau
Enologia, propietats del vi, aerometria, refractometria, paràmetres de qualitat.
abstract
Using wine as a conductor, a set of experiences aimed at secondary, while being easily extendable university students, are proposed. Some of them adapt easily implemented winemaking techniques while being low cost, and in some cases are performed with homemade measuring built by students. The experiences help integrate phenomena in chemistry and physics to the methodology of wine culture testing quality control.
keywords
Properties of the wine, aerometry, refractometry, parameters of quality.
Introducció
El vi, suc de raïm fermentat, està íntimament lligat a la cultura mediterrània, ja que el clima és ideal per al cultiu de la vinya. Hi ha indicis que l’home conrea la vinya i en produeix vi des de fa uns sis mil anys. Una de les raons per les quals els conqueridors van introduir la vinya a Amèrica va ser precisament disposar de vi per celebrar la missa. Durant l’edat mitjana, el consum de vi era, a més, una mesura profilàctica, almenys a l’Europa meridional, ja que les aigües estaven fortament contaminades i era molt perillós beure’n. L’alcohol contingut al vi en garantia la salubritat. Al nord d’Europa, amb el mateix empirisme, es bevia cervesa.
Avui dia, la producció de vi ha esdevingut una activitat professional feta amb molt rigor. Els pro-
cessos lligats a la indústria del vi han donat origen a una autèntica ciència, l’enologia, que té l’objectiu fonamental d’aconseguir vins òptims i de gran valor gastronòmic i econòmic. La certificació de les qualitats d’un vi, al marge de la sensibilitat del mestre tastavins, que sempre serà subjectiva, està regulada per un conjunt de mesures normalitzades que permeten una determinació objectiva de les seves propietats (García Cazorla, Xirau Vayrea i Azorín Romero, 2005).
En aquest treball es proposen experiments entorn del vi, molts derivats dels que es fan a la indústria, que permeten divulgar el paper de la química en àmbits científics aplicats, com és l’enologia. Es poden dur a terme en fires de ciències o a les aules de l’ensenyament no universitari.
Què és el vi?
El vi és el suc fermentat del fruit de la vitis vinifera, que es conrea almenys a l’Europa meridional i central, a parts d’Amèrica, Sudàfrica i Austràlia. N’hi ha moltes varietats i a cada regió es conreen les més adaptades al terreny.
El raïm conté entre un 15 % i un 25 % de glucosa i fructosa, glúcids monosacàrids. En un raïm ben madur, la relació entre glucosa i fructosa és aproximadament de 0,95, però la glucosa fermenta més que la fructosa i al final del procés la relació es redueix a 0,3. Per acció del llevat Saccharomices cerevisiae, que produeix un conjunt enzimàtic anomenat zimasa, els glúcids es descomponen segons la reacció de fermentació alcohòlica de Gay-Lussac per donar alcohol (Leuthardt i Eldbacher, 1962; Finar, 1980):
57 ISSN 2013-1755, SCQ-IEC Educació Química EduQ número 18 (2014), p. 57-62 DOI: 10.2436/20.2003.02.136 http://scq.iec.cat/scq/index.html
= CO2 + CH3 − CH2OH
Aquesta és una expressió simplificada del que realment ocorre, que és un conjunt de reaccions molt complicades (Leuthardt i Eldbacher, 1962).
Actualment és comú que, un cop premsat el raïm, s’hi afegeixin ceps de llevats preparats al laboratori de forma molt controlada. Una de les tasques dels enòlegs és precisament la recerca de llevats excel·lents. En la fermentació, avui dia, el control és exhaustiu, i es controla especialment la temperatura. La fermentació és més lenta si la temperatura és baixa.
El vi també conté àcids propis del raïm o que són conseqüència de la fermentació, com ara tàrtric (tartàric), màlic, tànnic, fòrmic, acètic, succínic o carbònic. Conté, a més, altres substàncies que són les responsables del gust, el color, l’olor i altres propietats organolèptiques. Moltes es van produint al llarg del procés d’envelliment del vi i depenen del lloc i de les condicions de conservació.
El most és el suc del raïm, que antigament s’obtenia trepitjant-lo o premsant-lo amb premses manuals. Actualment, el procés està més industrialitzat, però petits productors continuen encara fidels a les tècniques tradicionals.
Anem al laboratori
En aquest article es proposen experiments amb most i vi, alguns dels quals podrien fer els alumnes o el professorat al laboratori escolar. Alguns són l’adaptació de mesures que es fan a la indústria i, per tant, hi ha un protocol determinat; a vegades, fins i tot hi ha textos legals que especifiquen molt bé les condicions de les mesures i l’instrumental necessari, sobretot quan es tracta de determinar paràmetres de qualitat.
Mesures de densitat
La densitat del vi i del most és un paràmetre que aporta molta informació. En enologia, se solen utilitzar dos conceptes molt semblants però no idèntics: la massa volúmica a 20 ºC i la densitat relativa
La massa volúmica a 20 ºC seria la massa d’una unitat de volum de vi o most mesurada a 20 ºC. Se simbolitza amb ρ 20 ºC i és el que els textos defineixen com a densitat absoluta . En enologia, se sol mesurar en g·mL −1 i normativament els resultats es donen amb quatre xifres decimals. Al sistema internacional, es mesuraria en kg·m −3
La densitat relativa a 20 ºC o densitat 20 ºC/20 ºC és la relació entre les masses volúmiques del vi (o del most) i de l’aigua, o bé entre les masses dels mateixos volums de vi i d’aigua. En els textos escolars s’anomena densitat relativa. En enologia, s’expressa també amb quatre decimals, però cal recordar que és adimensional (García Cazorla, Xirau Vayrea i Azorín Romero, 2005; Martínez Pons, 2012).
Aerometria
Per mesurar la massa volúmica, el mètode més habitual és
l’aerometria, que es basa en el principi d’Arquímedes. La mesura es pren sobre la tija d’un flotador calibrat que surt del líquid (fig. 1).
L’instrument rep el nom de densímetre o aeròmetre, però, quan està optimitzat per a alcohols, se sol anomenar alcoholímetre. Alguns tenen una graduació en graus alcohòlics i permeten una lectura directa d’aquest paràmetre.
La normativa indica que s’abocaran 250 cm3 de vi en una proveta, se’n mesurarà la temperatura i s’introduirà el densímetre. La lectura es fa per la part alta del menisc. El que s’obté és la massa volúmica aparent, ρt Per trobar la massa volúmica a 20 ºC, s’aplicarà la relació
ρ20 ºC = ρt + c
on c és un valor que es troba tabulat en funció de la temperatura (García Cazorla, Xirau Vayrea i Azorín Romero, 2005).
Els densímetres són delicats, tenen un rang de treball molt limitat i cal disposar de més d’un. Per exemple, el densímetre 1,00-1,100 només val per a 1,000 ≤ ρt ≤ 1,100.
Una altra possibilitat que millora la comprensió dels fenòmens implicats és que els alumnes construeixin un densímetre casolà, l’esquema del qual es

Educació Química EduQ número 18 58
C6H12O6
Figura 1. Esquema del densímetre.
mostra a la fig. 1. Es necessita una càpsula de plàstic d’entre 1 i 2 cm de diàmetre i entre 5 i 7 cm de llargària, com ara un tros de carcassa d’un bolígraf. S’hi introdueixen uns quants perdigons fixats amb plastilina i es tapa amb un tap travessat amb un bastonet d’uns 6 o 7 cm. Convé que s’enfonsi aproximadament fins a la meitat de la tija; per aconseguir-ho, s’hi afegeixen o se’n treuen perdigons. Finalment, se segella per evitar possibles entrades de líquid, es calibra amb dues solucions patró (màxim i mínim) i es marquen divisions regulars.
Picnometria (Martínez Pons, 2012)
Un altra eina per mesurar la densitat és el picnòmetre, que serveix específicament per mesurar la densitat, absoluta o relativa, tant de líquids com de sòlids (fig. 2).
Per mesurar la densitat absoluta, si s’està a la temperatura de calibratge, es pesa el picnòmetre buit i complet (m0). Tot seguit, s’omple amb el líquid a analitzar, s’enrasa i es torna a pesar (m1). Com que es coneix el volum i la massa, es pot calcular la densitat:

2. Esquema d’un picnòmetre i imatge d’un picnòmetre estàndard i un altre construït pels alumnes.
Els alumnes també poden construir un picnòmetre casolà emprant una ampolla petita, un tap de goma que ajusti bé i un tub sobre el qual es marcarà l’aforament (fig. 2).
Per mesurar la densitat relativa, es procedeix de la mateixa forma que amb el picnòmetre. El recipient s’omple d’aigua destil·lada, s’enrasa i es pesa (m2), i es calcula la densitat relativa:
La taula 1 mostra, com a referència, els resultats que caldria esperar.
Mesura del grau alcohòlic del most (grau Brix)
L’experiment comença amb l’obtenció de most premsant una mica de raïm i recollint-ne el suc. També es pot fer servir una liquadora.
El grau alcohòlic es determina per la mesura de la quantitat de sucre per refractometria o per aerometria.
Refractometria
L’índex de refracció, n, d’un medi transparent és la relació entre la velocitat de la llum al buit (o a l’aire) i al medi. Per tant, n ≥ 1. En les solucions amb sucre, aquest índex depèn de la concentració, la qual s’acostuma a expressar en graus Brix (ºBx), que és la massa de sacarosa continguda en 100 g d’una solució que tingui el mateix índex de refracció que la mostra. Una dissolució d’1 ºBx és aquella en la qual l’índex de refracció és el mateix que el d’una dissolució aquosa que conté un 1 % de sacarosa.
La mesura es basa en l’aplicació de la segona llei de Snell de la refracció. Si α i β són, respectivament, els angles d’incidència i de refracció d’un raig lluminós, es compleix que n1 sin α = n2 sin β Si el medi extern és l’aire (n1 ≅1), per tant: n = sin α sin β
L’índex de refracció i el grau Brix es relacionen segons la correlació empírica
n=0,00166×(ºBx)+ 1,33063; ºBx=6,0090502 n-799,58215
(García Cazorla, Xirau Vayrea i Azorín Romero, 2005)
que val per a un valor de graus Brix comprès entre 15 i 25. Normativament, la mesura ha de fer-se a una temperatura de 20 ºC. Es fa habitualment amb el refractòmetre d’Abbe (fig. 3), que
Una altra eina per mesurar la densitat és el picnòmetre, que serveix específicament per mesurar la densitat, absoluta o relativa, tant de líquids com de sòlids
Taula 1. Valors màxims i mínims de la massa volúmica d’alguns vins i derivats (García Cazorla, Xirau Vayrea i Azorín Romero, 2005) Vi blanc sec Vi negre sec Cava Vi de licor (dolç) Most Mín. Màx. Mín. Màx. Mín. Màx. Mín. Màx. Mín. Màx. ρ20 (g/mL) 0,9880 0,9930
Monografia / Recursos didàctics 59 El vi com a recurs didàctic
���� = ����! ����! ����
���� = ����! ����! ����! ����!
Figura
0,9910 0,9890 0,9890 1,0080 1,0500 1,0700 1,0590 1,1150
consisteix en un prisma on se situa la mostra i un objectiu amb una escala superposada que pot estar graduada en graus Brix o en valors de n
També es pot construir un refractòmetre casolà, menys precís però més didàctic
Material: dos petits gots iguals, vi negre, aigua i una targeta de plàstic llisa.
L’experiment consisteix a omplir un got de vi i l’altre d’aigua i,
També es pot construir un refractòmetre casolà, menys precís però més didàctic, fet amb cinc vidres portaobjectes units amb resina epoxi (fig. 4). Cal calibrar-lo abans de cada mesura; per fer-ho, cal situar-lo davant d’una pantalla on es col·loca un full de paper i on s’utilitzen solucions de sucre de concentració coneguda. Es dirigeix un raig de llum làser i es marca sobre el paper la posició del raig d’arribada (refractat). A continuació, es fa el mateix amb el most i, per interpolació, en el gràfic de calibratge s’obté la concentració equivalent o el grau Brix (Martínez Pons, 2009).
Mètode per aerometria
Si es coneix la massa volúmica del most, es pot calcular el grau alcohòlic esperat aplicant l’expressió matemàtica següent:
Grau alcohòlic (% volum) = 150,5537 ρ20 ºC − 151,4771 (García Cazorla, Xirau Vayrea i Azorín Romero, 2005)
Un curiós experiment relacionat amb el vi i la seva densitat És un experiment molt vistós que es pot utilitzar, fins i tot, per demostrar algunes propietats bàsiques de la mecànica de fluids.

4. Esquema del refractòmetre casolà i de la seva utilització.
Nota: el raig lluminós no està rigorosament dibuixat perquè les desviacions són molt petites, però vénen augmentades quan l’objectiu projecta sobre l’escala.
llavors, transvasar el vi al got de l’aigua i l’aigua al got del vi sense cap altre instrument que la targeta (fig. 5).
Per fer-ho, s’explica que el vi és una mica menys dens que l’aigua. Per tant, el vi suraria sobre l’aigua. El vi i l’aigua són miscibles i, en aquest cas, es tracta d’evitar que es mesclin.
Per aconseguir-ho, el got de l’aigua, ben ple, es tapa amb la targeta i se li dóna la volta subjectant la targeta. Es pot preguntar si es podria deixar de subjectar la targeta. El vi cauria? L’explicació requereix el concepte de pressió atmosfèrica
Es col·loca el got de l’aigua sobre el del vi ajustant molt bé les vores. Llavors, amb molta precaució, es retira la targeta de manera que entre ambdós gots s’obri una petita ranura. S’observa com inicialment el vi ascendeix en forma de petits remolins. Ràpidament, el flux s’estabilitza i el vi comença a situar-se sobre l’aigua. Tot i que no es veu, l’aigua va davallant al got del vi i es diposita al fons. Finalment, es pot observar que la interfase no és gaire definida, ja que hi ha difusió entre aigua i vi.
60 Educació Química EduQ número 18
Figura
Figura 3. Esquema i imatge del refractòmetre d’Abbe amb la tapa aixecada.



Grau del vi (GAV)
El grau d’alcohol del vi informa de la concentració d’alcohol que conté. Comercialment, se sol utilitzar el grau d’alcohol volumètric (GAV), que es defineix com els cm3 d’alcohol continguts en 100 cm3 de vi.
Industrialment, es mesura pel mètode de destil·lació i una posterior aerometria del producte o per ebullioscòpia. Ambdós mètodes són complexos per l’instrumental que requereixen; per això es proposa fer una destil·lació simple amb el vi i esbrinar com la temperatura d’ebullició varia amb la presència d’alcohol.
Destil·lació
La destil·lació va ser considerada pels alquimistes com un instrument de purificació de les substàncies. És el fonament de l’obtenció dels licors espirituosos, que generalment es fan destil·lant una o més vegades vi o un altre líquid fermentat i, posteriorment, afegint-hi substàncies aromàtiques, com ara herbes o derivats dels recipients on se’ls deixa envellir.
Artesanalment, es continua utilitzant l’alambí, que no difereix gaire del que empraven els alquimistes. Els artesans licoristes solen controlar el grau del licor que produeixen observant el ritme de caiguda de la gota. És interessant que els alumnes vegin funcionar petits alambins d’aram.
Durant el procés es pot produir el trencament de la molècula d’etanol, la qual cosa dóna lloc al metanol, que és altament tòxic.
En dur a terme la destil·lació simple, cal que es vetlli per la correcta entrada i sortida de l’aigua del refrigerador i per la correcta posició del termòmetre tot explicant-ne la raó.
Per mesurar la graduació per aerometria, s’introdueix l’aeròmetre o alcoholímetre en el destil·lat obtingut i es llegeix el valor del grau alcohòlic.
Acidesa del vi
En enologia, el concepte d’acidesa del vi admet matisos. L’acidesa total (AT) es refereix a la suma de tots els àcids valorables en conjunt, amb hidròxid de sodi fins a pH 7. Internacionalment, s’aconsella prendre 8,2 com a pH d’equivalència, ja que els àcids continguts són dèbils i es valoren amb una base forta. Els àcids més comuns al vi són el tartàric, el màlic, el làctic i l’acètic, molt importants per les seves característiques organolèptiques. Els dos primers provenen del mateix raïm i també són presents al most. L’àcid acètic és conseqüència de la fermentació malolàctica, un procés associat a la fermentació. També hi ha àcid cítric, ascòrbic, succínic i d’altres, però en quantitats molt petites. Al vinagre, l’àcid més important és l’acètic. Cal tenir present que l’AT no inclou el
diòxid de carboni ni l’òxid de sofre (García Cazorla, Xirau Vayrea i Azorín Romero, 2005).
L’AT del most disminueix amb la fermentació perquè l’àcid tartàric precipita en forma de tartrat i bitartrat de calci. La solubilitat d’aquestes sals disminueix quan augmenta la concentració d’alcohol i baixa la temperatura (estabilització per fred).
L’acidesa volàtil (AV) és deguda a l’àcid acètic i a altres àcids de la mateixa sèrie que es troben al vi en forma lliure o formant sals.
L’olor a picat que presenten alguns vins es deu principalment a l’àcid acètic i a un èster, l’acetat d’etil. El nivell sensorial d’aquestes substàncies és de l’ordre de 0,6 g/L, per a la primera, i 0,1 g/L, per a la segona.
En enologia, el concepte d’acidesa del vi admet matisos. L’acidesa total (AT) es refereix a la suma de tots els àcids valorables en conjunt, amb hidròxid de sodi fins a pH 7. Internacionalment, s’aconsella prendre 8,2 com a pH d’equivalència, ja que els àcids continguts són dèbils i es valoren amb una base forta
Monografia / Recursos didàctics 61 El vi com a recurs didàctic
Fig. 5. a) Abans de començar; b) el vi comença a pujar; c) el vi se situa per sobre de l’aigua sense barrejar-se.
) b
c
a
)
)
El nom d’ acidesa volàtil fa referència al fet que els àcids causants es poden separar mitjançant una destil·lació fraccionada del vi. Precisament la destil·lació del vi i la valoració del producte són el fonament del mètode García-Tena per a la seva determinació.
Al vi i al most, l’AT s’expressa en g/L d’àcid tartàric. Segons la normativa, es calcula valorant 10 mL de vi o most amb hidròxid de sodi 0,1332 M i indicador de blau de bromotimol.
Al laboratori escolar es pot fer la valoració, però no cal una concentració tan precisa. Si M és la molaritat de la sosa i es gasten v mL en la valoració, aleshores:
AT = (v · M · 75) 10 (g/L d’àcid tartàric)
Pot ser un bon exercici el fet que els alumnes dedueixin la fórmula recordant que la massa molecular de l’àcid és 150.
A la taula 2 es mostren alguns dels valors límit permesos per la legislació actual.
El grau d’alcohol del vi informa de la concentració d’alcohol que conté
didàctic apropi l’alumnat al paper de la química en la societat i ajudi a donar a conèixer les seves aplicacions. El conjunt dels experiments pot ajudar a comprendre alguns fenòmens i tècniques, així com a recordar que avui la qualitat dels productes ha de ser determinada per mitjà de mètodes objectius. Per tant, les mesures han de ser preses amb rigor i expressades de manera uniforme. Els experiments i les informacions exposades podrien ampliar-se amb moltes mesures i observacions d’ordre químic, industrial i biològic. Per exemple, es pot fer un seguiment de la fermentació alcohòlica o malolàctica, o fer un recompte microscòpic de llevats, o determinar la quantitat de diòxid de sofre contingut. Aquests assajos, però, requereixen instrumental i un grau de dificultat sovint massa elevat per a estudiants de secundària.
Taula 2. Valors de referència d’acideses total i volàtil
Tipus de mostra
Acidesa total en g/L (expressada en àcid tartàric)
Acidesa volàtil en g/L (expressada en àcid acètic)
Referències
FinAr, I. L. (1980). Química orgánica Vol. 2. Madrid: Alhambra. gArcíA cAzorlA, J. ; xirAu vAyreA, M.; Azorín romero, R. (2005). Técnicas usuales de análisis en enología. Montcada i Reixac: Panreac.
leutHArdt, F.; eldBAcHer, S. (1962). Tratado de química fisiológica. Madrid: Aguilar.
mArtínez Pons, J. A. (2009). «La preparación de la mermelada como recurso didáctico». Anales de la Real Sociedad Española de Química, vol. 105, núm. 1, p. 221-226. (2012). «La corona de Gerión y el eureka de Arquímedes». Anales de la Real Sociedad Española de Química, vol. 109, núm. 2, p. 119-125.
nijveldt, R. J.; nood, E. van; Hoom, D. E. van; Boelens, P. G. (2001). «Flavonoids: a review of probable mechanism of action and potential applications». Am. J. Clin. Nutr., vol. 74, núm. 4, p. 418425.

José Antonio Martínez Pons
Conclusions
La utilització d’aquest tipus d’experiències a l’aula i el fet que es tracti de determinacions que tenen una utilitat i una aplicació en el món industrial (i, en concret, en enologia) fa que aquest recurs
Dedicatòria
L’autor vol dedicar aquest treball a son professor de biologia a batxillerat, després amic i sempre mestre, el Dr. P. Rafel Genestar Serra, TOR, expert en llevats. In memoriam
Va ser catedràtic de Física i química a l’IES Las Lagunas de Rivas-Vaciamadrid i professor associat a la Universitat d’Alcalà, a la Politècnica (Escola Universitària d’Informàtica) i a la Universitat Antonio de Nebrija. És llicenciat en ciències físiques per la Universitat Complutense, en químiques per la UNED i doctor en ciències químiques per la Universitat d’Alcalà. Els seus camps d’interès són la didàctica, la informàtica i la divulgació. Com a investigador, està interessat en la teoria del caos aplicada, sobretot, a l’enginyeria química.
A/e: jamartinez46@gmail.com.
Educació Química EduQ número 18 62
≤ 0,12 Sangria 3,6-10,0 ≤ 0,6
(wine coolers) 4,0-8,0 ≤ 0,3
≥
≤
Most 3,5-10,0
Refresc de vi
Vi «tranquil»
4,5 Vi base per espumós ≥ 5,5
0,60 Vi espumós ≥ 5,5 ≤ 0,65
NORMES DE PUBLICACIÓ
Preparació dels manuscrits
Elsarticleshandeferreferènciaaqualsevoldelstemesde
lesseccionsdelarevistaperaqualsevolnivelld’ educació,des
deprimàriafinsal’ educacióuniversitàriaHandeserinèditsi
hand’ estarescritsencatalà,totiquetambéespublicaranarti-
clesencastellà,francès,portuguès,italiàianglès,sil’ autoriaés
depersonesdeforadel’àmbitdelallenguacatalana
Elstreballshandetenirunaextensiómàximade25000ca-
ràcterssenseespaisihandeserescritsambunespaiatd’1,5i
handetenirelnombredecaràctersambespaisespecificaten
cadascunadelesseccionsdelarevistaEltexthad’ estaren
formatMicrosoftWordilletraTimesNewRomandecos12
Laprimerapàginahadecontenireltítoldeltreball,elnomo
nomsdelsautorsielcentreocentresdetreball,unresumde
500caràcters(incloent-hiespais)icincparaulesclauEltítol,el
resumilesparaulesclauhand’ anarseguitsdelasevaversió
enanglèsCalenviartambél’ adreçapostaldelsautorsoladel
centredetreballperpoderenviar-loselnúmerodelarevistaen
quèhanparticipat
Elsarticleshand’ anaracompanyatsdefotografiesiimatges
encolorqueillustrinelcontingutdeltextL’ articlehauràde
contenirfotografiesencolordeltreballal’ aula,delsmuntatges
delsexperimentsoaltresfotografiesrelacionadesambelcon-
tingutTambéhandecontenirgràfics,esquemes,dibuixositre-
ballsoproduccionsdelsalumnesqueillustrinifacinmés
comprensibleelcontingutdeltextLesillustracionshande
portartítol(peud’imatge)icalindicaroncalsituar-lesdins
l’ articleLesfotografiesiimatgess 'hand' enviarenarxiussepa-
ratsenformattifojpeg(resoluciómínima:300píxels/pol-
zada)i,siestractadegràfics,enExceloCorelDraw
L’ articlehad’ estarestructuratendiferentsapartatsElsau-
torshandeseguirlesnormesrecomanadesperlaIUPACa
l’horad’ anomenarelscompostsquímicsiutilitzarelsistema
internacionald’ unitatsÉsconvenientelfetd’ assenyalar3o4
frasesd el ’ a r t i c l eq u ee sd e s t a c a ra na m bu n al l e t ram é s
g ra nid ec o l o re nl ’ a r t i c l em a q u e t a t
Lesreferènciesbibliogràfiqueshand’ anaralfinaldeltext,es-
critescomelsexemplessegüents:
Per a llibres:
VILCHES,A;GIL,D(2003) Construyamos un futuro sostenible: Diálogos de supervivencia Madrid:CambridgeUniversityPress
Citacióeneltext:(VichesiGil,1994)
Per a articles:
SARDÀ,A;SANMARTÍ,N(2000)«Ensenyaraargumentarcientífi-
cament:unreptedelesclassesdeciències» Enseñanza de las Ciencias,vol18,núm3,p405-422
Citacióeneltext:(SardàiSanmartí,2000)
Per a documents digitals (webs):
OCDE(2006) PISA 2006: Marco de la evaluación Conocimientos y habilidades en Ciencias, Matemáticas y Lectura [recurselectrònic]París:
OCDE<http://wwwoecdorg/dataoecd/59/2/39732471pdf>
[Consulta:11setembre2013]
Peraaltresexemples,consulteuunnúmerorecentdelare-
vista
Alfinaldel’ articlehadeconstarunabreuressenyaprofes-
sionaliunafotografiadelespersonesautoresdel’ articleCada
ressenyahadecontenirelnomicognoms,càrrec,centredetre-
ball,campprincipalenelqualdesenvolupalasevatascaico-
rreuelectrònic(màximde400caràctersambespais)Calenviar
elsarxiusdelesfotografiesdecarnetdelsautorsenformattif
ojpeg(resoluciómínima:300píxels/polzada)
Enviament d’articles
Elsarticleshandeserenviatspercorreuelectrònical’ adreça
següent: EduQ@iec cat
Revisió dels articles
E l sa r t i c l e ss e ra nrev i s a t sp e rt re se x p e r t sE l sa r t i c l e sre -
v i s a t sie nv i a t sa l sa u t o r sh a u ra nd es e rre t o r n a t sa l se d i -
t o r se ne lt e r m i n im à x i md e1 0d i e sS e m p req u es i g u i
p o s s i b l e,l e sp rove sd em a q u e t a c i ós e ra ne nv i a d e sa l sa u t o r s
a b a n sd el as evap u b l i c a c i ó
SECCIONS
ACTUALITZACIÓ DE CONTINGUTS
Articlesquereviseniposenaldiacontingutspropisdeladisciplinaoen relacióaaltresàmbitsdelconeixement,iquefacilitenipromouenun
ensenyamentactualitzatdelaquímica
APRENENTATGE DE CONCEPTES I MODELS
Articlesquetractensobreconceptesimodelsquímics,desdelpuntde
vistadelesconcepcionsalternativesdelsalumnesilesdificultatsd’ a-
prenentatgeconceptuals,aixícomlesestratègiesdidàctiquesperal’ ela-
boracióil’ aplicaciódelsmodelsquímicsal’ aula
CURRÍCULUM, PROJECTES I UNITATS
Presentacióianàlisidelscurrículumsdequímicadediferentspaïsos,de
projectescurricularsiunitatsiseqüènciesdidàctiques
DIVULGACIÓ DE LA QUÍMICA
Articlesquepresententemesd’ actualitatquímicaambcaràcterdivulga-
tiuiqueposendemanifestlesrelacionsdelaquímicaamblasocietati
altresàmbitsdelconeixementobépresentenactivitatsiexperiènciesde
cairedivulgadordelaquímicaadreçadesal’ alumnatoalpúblicenge-
neral
ESTRATÈGIES DIDÀCTIQUES
Presentacióianàlisid’ enfocamentsiestratègiesdidàctiquesperal’ ensenyamentil’ aprenentatgedelaquímica:modelització,indagació,resolu-
ciódeproblemes,treballcooperatiu,avaluació,etc
FORMACIÓ DEL PROFESSORAT
Propostesiinvestigacionssobrelaformacióinicialienactiudelprofessoratdequímicaiciènciesengeneralquecontribueixinalseudesenvo-
lupamentprofessional
HISTÒRIA I NATURALESA DE LA QUÍMICA
Articlessobrelahistòriailanaturalesadelaquímicaisobrel’interèsdi-
dàcticd’ aquestesdisciplinesenl’ ensenyamentdelaquímicaActivitats
pertreballaraspectesdelanaturalesadelaciència
INNOVACIÓ A L’AULA
Articlesquedescriuenlaplanificacióil’ experimentacióal’ aulad’ expe-
riènciesdidàctiquesdecaràcterinnovadorLasecciópreténserunespai
percompartirexperiènciesd’ aula
LLENGUATGE, TERMINOLOGIA I COMUNICACIÓ
Articlesrelacionatsambl’ aprenentatgedeleshabilitatscomunicatives
(llegir,escriureiparlar)enrelacióambl’ aprenentatgedelaquímicaI
tambésobreelllenguatgeilaterminologiacientífics
NOVES TECNOLOGIES
Articlesrelacionatsamblautilitzaciódelesnovestecnologiesenl’ ensenyamentdelaquímica:simulacions,úsd’Internet,mitjansaudiovisuals,
laboratorisvirtuals,experiènciesambequipsdecaptaciódedades,etc
QUÍMICA EN CONTEXT
Articlesquepresentencontextosrellevants–delavidaquotidiana,tec-
nològics,industrials,socials,mediambientals,desalutoculturals–que
puguinserpresoscomapuntdepartidaperaunensenyamentdela
químicaencontextiperpromourel’ alfabetitzaciócientífica
QUÍMICA, EDUCACIÓ AMBIENTAL I SOSTENIBILITAT
Articlesquefacinpalesal’ estretaderelacióentrelaquímicaielsaspec-
tesdelmediambient,itemàtiquesmediambientalsd’ actualitatdes
d’ unavessantquímica,aixícomproposteseducativesperalasostenibi-
litat
RECERCA EN DIDÀCTICA DE LA QUÍMICA
Articlesquedifonguininvestigacionsdidàctiquesd’ utilitatperalami-
lloradel’ ensenyamentdelaquímicaDescripcióiresultatsd’ experièn-
ciesdidàctiquesquehaginestatavaluadesdeformaqualitativao
quantitativa
RECURSOS DIDÀCTICS
Articlesquepresentinqualsevoltipusderecursimaterialdidàcticpera
l’ ensenyamentdelaquímicaPodenincloure,entred’ altres,audiovisu-
als,jocs,visites,textosdelsmitjansdecomunicació,etc
TREBALL EXPERIMENTAL
Articlessobrediferentstipusdetreballspràcticsexperimentals:demos-
tracions,experiènciesinterpretatives,aprenentatgedetècniques,investi-
gacions,etc
TREBALLS DE RECERCA DELS ALUMNES
Articlesdescriptiusdetreballsderecercadelsalumnesdinsl’àmbitde
laquímicaEnaquestasecció,elsalumnessónelsautènticsprotagonis-
tes
Properes monografies
L’àtom
Química en context
Enllaç i estructura








 Aureli Caamaño i Fina Guitart Editors d’Educació Química EduQ
Josep Duran
Coordinador de la monografia «Divulgació de la química»
Aureli Caamaño i Fina Guitart Editors d’Educació Química EduQ
Josep Duran
Coordinador de la monografia «Divulgació de la química»




















































































